
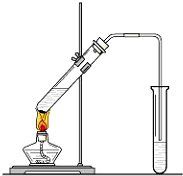
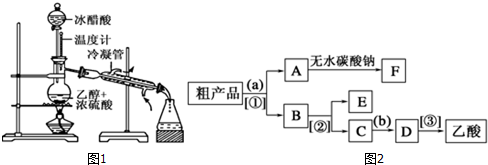
 在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:分析 (1)乙酸与乙醇发生酯化反应生成乙酸乙酯和水,醇脱H,羧酸脱羟基;
(2)酯化反应为可逆反应,且浓硫酸具有吸水性;
(3)饱和碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(4)将浓硫酸、甲醇、乙醇、甲酸、乙酸五种物质按一定比例混合,可形成甲酸甲酯、甲酸乙酯、乙酸甲酯、乙酸乙酯;
(5)乙醇与乙酸的反应已达到化学平衡状态,各组分的含量不变、正逆反应速率相等,以此来解答.
解答 解:(1)由CH3COOH与C2H518OH制取乙酸乙酯的化学反应方程式为CH3COOH+CH3CH218OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OCH2CH3+H2O,
故答案为:CH3COOH+CH3CH218OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OCH2CH3+H2O;
(2)该反应需加入一定量的浓硫酸,则浓硫酸的主要作用是催化剂和吸水剂,
故答案为:催化剂和吸水剂;
(3)右边试管内所盛饱和碳酸钠溶液的主要作用是降低乙酸乙酯的溶解度、溶解乙醇杂质、除去乙酸杂质,
故答案为:降低乙酸乙酯的溶解度、溶解乙醇杂质、除去乙酸杂质;
(4)将浓硫酸、甲醇、乙醇、甲酸、乙酸五种物质按一定比例混合,可形成甲酸甲酯、甲酸乙酯、乙酸甲酯、乙酸乙酯,则经分液分离出的酯类物质理论上有4种,
故答案为:4;
(5)①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,不能体现正逆反应速率,不能判定平衡状态,故不选;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,正逆反应速率相等,能判定平衡状态,故选;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,不能体现正逆反应速率,不能判定平衡状态,故不选;
④正反应速率与逆反应速率相等,能判定平衡状态,故选;
⑤反应混合物中各物质的浓度不再变化,能判定平衡状态,故选;
故答案为:②④⑤.
点评 本题考查有机物的制备实验,为高频考点,把握物质的制备原理、性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意平衡移动及平衡判定的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
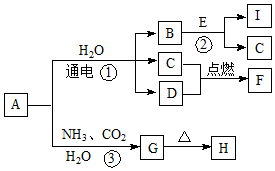
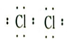 .
. 
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO |
B | 将干燥的Cl2通过有色鲜花 | 鲜花褪色 | Cl2有漂白性 |
C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生气体 | Na2O2没有变质 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:实验题
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
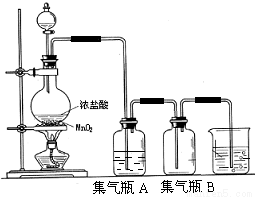
试回答下列问题:
(1)请指出 是氧化剂, _是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水 中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实的分析正确的是
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被氧化
D.亚硝酸盐被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
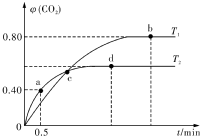 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)═5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4molCO,测得CO2的体积分数随时间t变化曲线如图.请回答:
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)═5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4molCO,测得CO2的体积分数随时间t变化曲线如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com