
| A. | 0.1 mol•L-1Ca(NO3)2溶液中:Na+、N${{H}_{4}}^{+}$、C${{O}_{3}}^{2-}$、CH3COO- | |
| B. | 能使甲基橙变红的溶液中:K+、Na+、N${{O}_{3}}^{-}$、Cl- | |
| C. | 3%H2O2溶液中:Fe2+、H+、S${{O}_{4}}^{2-}$、Cl- | |
| D. | 0.1 mol•L-1KSCN溶液中:Fe3+、N${{H}_{4}}^{+}$、Br-、S${{O}_{4}}^{2-}$ |
分析 A、钙离子与碳酸离子结合形成难溶的碳酸钙;
B、使甲基橙变红的溶液为酸性溶液,K+、Na+、NO3-、Cl-离子之间不发生反应,也不氢离子反应;
C、亚铁离子具有还原性,而过氧化氢具有氧化性,两者要发生氧化还原;
D、KSCN溶液与铁离子形成络合物.
解答 解:A、钙离子与碳酸离子结合形成难溶的碳酸钙,所以碳酸根离子不能大量共存,故A错误;
B、使甲基橙变红的溶液为酸性溶液,K+、Na+、NO3-、Cl-离子之间不发生反应,也不氢离子反应,故B正确;
C、亚铁离子具有还原性,而过氧化氢具有氧化性,两者要发生氧化还原,所以亚铁离子不能共存,故C错误;
D、KSCN溶液与铁离子形成络合物,所以铁离子不能存在体系中,故D错误;
故选B.
点评 本题考查离子共存的正误判断,该题是高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 消去-取代-加成 | B. | 取代-消去-加成 | C. | 消去-加成-水解 | D. | 水解-取代-取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极上发生还原反应 | |
| B. | 电池工作时,铜电极附近会出现蓝色 | |
| C. | 锌片失去的电子通过番茄汁流向铜电极 | |
| D. | 工作一段时间后,两极质量均减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 路线:
路线:
 .
.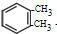 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$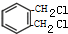 +2HCl
+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式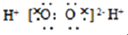 | |
| B. | NH4I的电子式 | |
| C. | 原子核内有8个中子的碳原子:${\;}_{8}^{14}$C | |
| D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
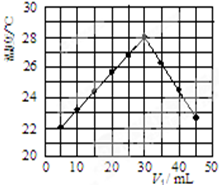 (一)实验方法测定反应热---------中和热测定
(一)实验方法测定反应热---------中和热测定| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1Cl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
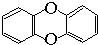 ,其一氯代物有( )
,其一氯代物有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 原子半径大小:Y<X<W | |
| C. | 氢化物的稳定性X<Y | |
| D. | X和Y形成的化合物升华破坏的是共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com