
| A. | 加入NaOH固体 | B. | 加入醋酸钠晶体 | C. | 加入盐酸 | D. | 降温 |
分析 醋酸中存在电离平衡CH3COOH?CH3COO-+H+,能使醋酸电离程度增大,说明平衡向正反应方向移动,可以采取的措施有:加水稀释、加热、加入和氢离子反应的物质等,据此分析解答.
解答 解:醋酸中存在电离平衡CH3COOH?CH3COO-+H+,能使醋酸电离程度增大,说明平衡向正反应方向移动,
A.加入NaOH固体,氢氧根离子和氢离子反应生成水促进醋酸电离,平衡向正反应方向移动,醋酸电离度增大,故A正确;
B.加入醋酸钠晶体,溶液中醋酸根离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,电离程度减小,故B错误;
C.加入盐酸,氢离子浓度增大,抑制醋酸电离,平衡向逆反应方向移动,电离程度减小,故C错误;
D.醋酸电离是吸热过程,降低温度抑制醋酸电离,则平衡向逆反应方向移动,电离程度减小,故D错误.
故选A.
点评 本题考查了弱电解质电离,题目难度不大,明确弱电解质电离影响因素即可解答,注意影响醋酸电离度的因素中只有温度影响电离平衡常数.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
A.已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为
b .①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
.①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ,C的燃烧热为 。
(3)CO的燃烧热为 ,其热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | HCl | C. | CaCO3(固体) | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
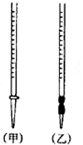 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
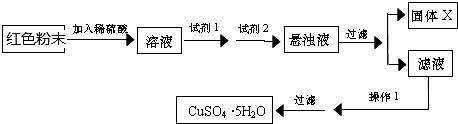
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com