
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.Na2O2+2HCl====2NaCl+H2O2
B.Ag2O+H2O2====2Ag+O2↑+H2O
C.2H2O2====2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH====2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同) ,H2O2既体现氧化性又体现还原性的反应是 。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是 。
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、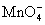 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72 L(标准状况)气体生成,转移的电子为 mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O====A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是
。
【解析】(1)H2O2在B反应中做还原剂,体现还原性,在C反应中既是氧化剂又是还原剂,在D反应中做氧化剂体现氧化性。
(2)B反应说明氧化性Ag2O>H2O2,D反应说明氧化性H2O2>K2CrO4,所以H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是Ag2O>H2O2>K2CrO4。
(3)根据题意可知,发生反应的离子方程式为
2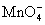 +5H2O2+6H+====2Mn2++5O2↑+8H2O。
+5H2O2+6H+====2Mn2++5O2↑+8H2O。
①由于Cl-能够被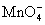 氧化,浓硫酸具有强氧化性,醋酸是弱酸,所以反应体系应选择稀硫酸。
氧化,浓硫酸具有强氧化性,醋酸是弱酸,所以反应体系应选择稀硫酸。
②根据反应的离子方程式可知,反应中有1 mol O2生成时,转移2 mol电子,如果反应中有6.72 L(标准状况)气体生成,即生成0.3 mol O2,则转移电子的物质的量为0.6 mol。
(4)根据质量守恒,反应可表示为KCN+H2O2+H2O====KHCO3+NH3↑,所以生成物A的化学式为KHCO3。H2O2做氧化剂时,其还原产物是H2O,H2O没有毒性及污染性,所以H2O2常被称为绿色氧化剂。
答案:(1)D C
(2)Ag2O>H2O2>K2CrO4
(3)①C ②0.6
(4)KHCO3 H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于氧化还原反应的是( )
A.SO2+H2O====H2SO3
B.H2CO3====CO2↑+H2O
C.2NaOH+H2SO4====Na2SO4+2H2O
D.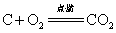
查看答案和解析>>
科目:高中化学 来源: 题型:
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、 NH3、N2、Cl-五种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是 ( )
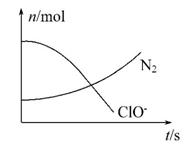
A.还原剂是NH3,氧化产物是Cl-
B.配平后氧化剂与还原剂的化学计量数之比为3∶2
C.该反应中氧化反应过程是ClO-→Cl-
D.标准状况下,若生成2.24 L N2,则转移电子为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中反应A(g)+2B(g) C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。
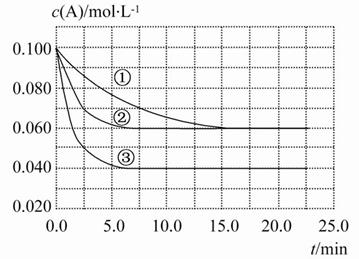
下列说法正确的是( )
A.若反应①、②的平衡常数分别为K1、K2,则K1<K2
B.反应A+2B C的ΔH>0
C的ΔH>0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
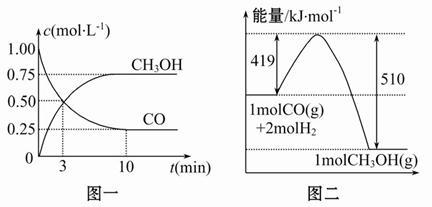
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=______,CO的转化率为________。
(2)该反应的平衡常数表达式为______________,温度升高,平衡常数______(填“增大”“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向_____(填“正”“逆”)反应方向移动,理由是______________________
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碳和硅的叙述中,正确的是( )
A.其氧化物都能与NaOH溶液反应
B.其单质在加热时都能跟O2反应
C.其氧化物都能溶于水生成相应的酸
D.碳和硅两种元素共有两种单质
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列原子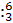 Li
Li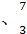 Li
Li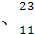 Na
Na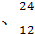 Mg
Mg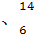 C
C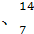 N,关于这些原子的说法中正确的是 ( )
N,关于这些原子的说法中正确的是 ( )
A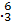 Li和
Li和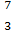 Li互为同素异形体
Li互为同素异形体
B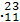 Na和
Na和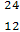 Mg的中子数相同
Mg的中子数相同
C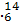 C和
C和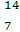 N的中子数相同
N的中子数相同
D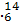 C和
C和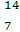 N的质子数相同
N的质子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com