
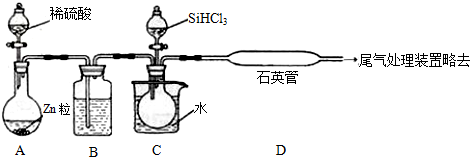
���� ��1�������£�̼�Ͷ������跴Ӧ���ɹ��һ����̼��
��2�������������ݣ����÷����ᴿSiHCl3��
��3�������ɵ���������ˮ��������ŨH2SO4������ȴ�ʹSiHCl3������
��SiHCl3��������Ӧ�й赥�����ɣ����ݹ����ɫ�ж�Dװ���е���ɫ�仯����Ӧ�¶Ƚϸߣ���ͨ������������SiHCl3��H2��Ӧ���ɹ���Ȼ��⣻
�������ǿ�ȼ�����壬�ײ�����ը��Ϊ��ֹ��ȫ�¹ʵķ�����������ͨһ��ʱ��H2����װ���еĿ����ž���
��ȡ������Ʒ���Թ��м������ܽ⣬�ٵμ���ˮ��KSCN��aq���������ֺ�ɫ˵����Fe���������ֺ�ɫ˵������Fe��
��� �⣺��1�������£�̼�Ͷ������跴Ӧ���ɹ��һ����̼����Ӧ����ʽΪ��SiO2+2C$\frac{\underline{\;����\;}}{\;}$Si+2CO����
�ʴ�Ϊ��SiO2+2C$\frac{\underline{\;����\;}}{\;}$Si+2CO����
��2��SiHCl3���е�33.0�棩�к�������SiCl4���е�57.6�棩��HCl���е�-84.7�棩�����ڷе���ϴ���ͨ�������ȥ���ʣ�
�ʴ�Ϊ������
��3����п��ϡ����ķ�Ӧ�Ƿ��ȷ�Ӧ���������ɵ���������ˮ������Ϊ����������һ��ѡ��ŨH2SO4�������ķ�Ӧ���ʽϴ����Լ��ȵ�Ŀ����ʹSiHCl3������
�ʴ�Ϊ��Ũ���ʹ������ƿ�е�SiHCl3������
�ڸ����£�SiHCl3��������Ӧ���ɹ赥�ʣ��赥���ǻҺ�ɫ���壬����Dװ���е������ǣ�ʯӢ�ܵ��ڱڸ��лҺ�ɫ���壻���ڸ����£���ͨ����������������ʹ��ʯӢ��������Ӧ����ʽΪ��SiHCl3+H2$\frac{\underline{\;����\;}}{\;}$Si+3HCl��
�ʴ�Ϊ��ʯӢ�ܵ��ڱڸ��лҺ�ɫ���壻�����£���ͨ������������SiHCl3+H2$\frac{\underline{\;����\;}}{\;}$Si+3HCl��
�������ǿ�ȼ�����壬�����������ﵽһ��ʱ�ײ�����ը��Ϊ��ֹ��ȫ�¹ʵķ�����������ͨһ��ʱ��H2����װ���еĿ����ž���
�ʴ�Ϊ���ž�װ���еĿ�����
�����ܺ��ᷴӦ�����������ӣ����������л�ԭ�ԣ����������ܱ���ˮ�������������ӣ������������軯����Һ���ɫ�����Կ�������ˮ�����軯����Һ�������Ĵ��ڣ�
��ѡbd��
���� ���⿼���Ʊ���������ƣ���Ŀ�Ѷ��еȣ�Ϊ�߿��ĸ�Ƶ�㣬��ȷʵ��Ŀ�ġ�ʵ��ԭ��Ϊ���ؼ���ע�����������Ʊ�������������۵�ԭ������������ѧ���ķ�����������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
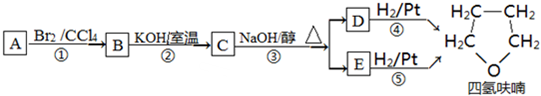
 +NaOH$��_{��}^{ˮ}$
+NaOH$��_{��}^{ˮ}$ +NaBr��
+NaBr��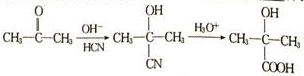 ��������ʾ����Ϣ��ģ��������ʾ������ͼ��ƺϳ�·�ߣ��Ա���Ϊ��Ҫԭ�Ϻϳ�
��������ʾ����Ϣ��ģ��������ʾ������ͼ��ƺϳ�·�ߣ��Ա���Ϊ��Ҫԭ�Ϻϳ�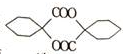 ������ÿһ���ķ�Ӧ�P��Ӧ�������л���д�ṹ��ʽ������ԭ����ѡ��
������ÿһ���ķ�Ӧ�P��Ӧ�������л���д�ṹ��ʽ������ԭ����ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 98.3%��������뵽ϡ����������Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ/mol | |
| B�� | ��Ca��OH��2��Һ�м�������NaHCO3��Һ������ɫ������Ca2++2OH-+2HCO3-�TCaCO3��+CO3-+2H2O | |
| C�� | 0.1mol/LNa2CO3��Һ�е�����ɫ��̪����Һ��죺CO32-+H2O�THCO3-+OH- | |
| D�� | Na2SO3��Һʹ����KMnO4��Һ��ɫ��5SO32-+6H++2MnO4-�T5SO42-+2Mn2++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
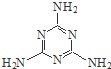 �ܰ�����Ҫ�Ĺ�ҵԭ�ϣ��ṹ��ʽ��ͼ����ҵ����Һ���Ͷ�����̼Ϊԭ�ϣ��轺Ϊ��������һ�������£�ͨ��ϵ�з�Ӧ�����ܰ�����ԭ����ȫ��Ӧ�����ܰ�����NH3��CO2������֮��ӦΪ��������
�ܰ�����Ҫ�Ĺ�ҵԭ�ϣ��ṹ��ʽ��ͼ����ҵ����Һ���Ͷ�����̼Ϊԭ�ϣ��轺Ϊ��������һ�������£�ͨ��ϵ�з�Ӧ�����ܰ�����ԭ����ȫ��Ӧ�����ܰ�����NH3��CO2������֮��ӦΪ��������| A�� | 17��44 | B�� | 22��17 | C�� | 17��22 | D�� | 2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH=4 CH3COOH��Һ��ˮϡ��10������Һ�и�������Ũ�Ⱦ���С | |
| B�� | �� CH3COOH��Һ�ζ������ʵ���Ũ�ȵ�NaOH��Һ�����ԣ�V��CH3COOH��Һ����V��NaOH��Һ�� | |
| C�� | ��0.2 mol•L-1��������Һ�м�������0.1 mol•L-1NH3•H2O��Һ��c��Cl-��+c��OH-���Tc��H+��+c��NH3•H2O�� | |
| D�� | �ں�0.1mol NaHSO4��Һ�У�c��H+���Tc��SO42-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K Na Li | B�� | Al Mg Na | C�� | N O C | D�� | Cl S P |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
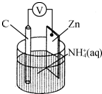
| A�� | ̼�缫�Ϸ�����ԭ��Ӧ | |
| B�� | Zn���Ϸ�����ԭ��Ӧ | |
| C�� | ����п�̸ɵ��Ϊ���ε�� | |
| D�� | �����Ϸ����ķ�ӦΪ2NH4++2e-�T2NH3��+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ���� | ���� |
| A | ��KI��FeCl3��Һ���Թ��л�Ϻ���CCl4������ | �²���Ϻ�ɫ | �����ԣ�Fe3+��I2 |
| B | ��ϡ�����м����������� | ��Һ��Ϊ��ɫ | ϡ���ὫFe������Fe3+ |
| C | ��ʢNa2SiO3 ��Һ���Թ��еμ�1�η�̪��Һ��Ȼ����μ���ϡ��������ɫ�ӽ���ʧʱֹͣ������ | �Թ���������� | �ǽ����ԣ�Cl��Si |
| D | ��������Һ�����Ƶ�������ͭ��ϼ��� | ��ש��ɫ�������� | �����Ƿ��������ǻ� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com