
【题目】据报道,1996年8月,我国科学家首次制出一种新核素镅—235,已知镅(Am)的原子序数为95,下列关于![]() 的叙述正确的是
的叙述正确的是
A. 镅—235与铀—235具有相同的质子数
B. 镅—235的原子质量是12C原子质量的235倍
C. 镅—235原子核内中子数为140,核外电子数为95
D. 镅—235原子一定不具有放射性
科目:高中化学 来源: 题型:
【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)以CO2与NH3为原料可合成尿素。已知
①2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.47 kJ·mol-1
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.49 kJ·mol-1
③H2O(l)=H2O(g) △H=+88.0 kJ·mol-1
写出NH3和CO2合成尿素和液态水的热化学方程式______________________________。
(2)海洋是地球上碳元素的最大吸收池。
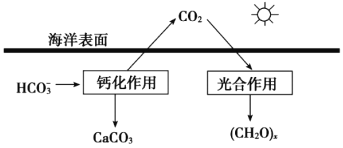
①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________、___________。
②在海洋碳循环中,可通过如图所示的途径固碳。写出钙化作用的离子方程式___________。
(3)常温常压下,空气中的CO2溶于水中达到平衡时,其转化关系如下:
①CO2+H2O![]() H2CO3 K=1.8×10-3
H2CO3 K=1.8×10-3
②H2CO3![]() H++HCO3- Ka1=4.3×10-7,
H++HCO3- Ka1=4.3×10-7,
③HCO3-![]() H++CO32- Ka2=5.6×10-11
H++CO32- Ka2=5.6×10-11
通常情况下,海水的pH约为8,若忽略水的电离及H2CO3的第二级电离,则溶液中c(CO2)=____________________________________________mol/L。(保留两位有效数字)
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。用1.0mol/L盐酸滴定吸收液,生成的V(CO2)随V(盐酸)变化关系如图1所示,则吸收液中离子浓度由大到小的顺序为__________,湖水中无机碳的浓度为___________mol/L。
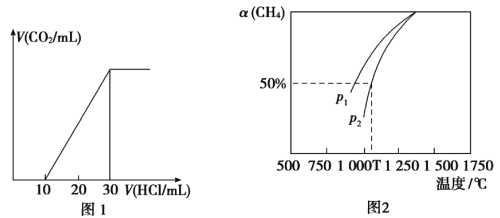
(5)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。ΔH
CH3OH(g)。ΔH
(1)平衡常数表达式为K=_______。
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是_______。
a. 升高温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 二氯甲烷只有一种结构,可以证明甲烷是正四面体结构
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 一定条件下,Cl2在甲苯的苯环或侧链上均能发生取代反应
D. ![]() 和CH3—CH==CH2互为同分异构体
和CH3—CH==CH2互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com