
 ;NH3的稳定性比PH3强(填写“强”或“弱”).
;NH3的稳定性比PH3强(填写“强”或“弱”).
 NH3•H2O
NH3•H2O NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;.
NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;.分析 (1)氮气中两个N原子共用3对电子达到最外层8电子稳定结构;依据同主族元素氢化物从上到下稳定性依次减弱的递变规律解答;
(2)①浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵;
②浓硫酸难挥发,能与氨气反应生成硫酸盐;
③FeSO4与碱反应生成白色沉淀氢氧化亚铁,氢氧化亚铁具有强的还原性,被空气中氧气氧化生成氢氧化铁,所以看到现象白色沉淀迅速变灰绿色沉淀,过一段时间后变成红褐色;
(3)结合NH3+H2O NH3•H2O
NH3•H2O NH4++OH-及平衡移动分析;
NH4++OH-及平衡移动分析;
(4)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水;结合元素的化合价变化计算.
解答 解:(1)氮气中两个N原子共用3对电子达到最外层8电子稳定结构,电子式为: ;N、P都是同主族元素,依据同主族元素氢化物从上到下稳定性依次减弱的递变规律,氨气的稳定性强于磷化氢;
;N、P都是同主族元素,依据同主族元素氢化物从上到下稳定性依次减弱的递变规律,氨气的稳定性强于磷化氢;
故答案为: ;强;
;强;
(2)①浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵,化学方程式:NH3+HCl═NH4Cl,
故答案为:NH3+HCl═NH4Cl;
②浓硫酸难挥发,能与氨气反应生成硫酸盐,则一段时间后浓硫酸的液滴中生成的白色固体为NH4HSO4或(NH4)2SO4,
故答案为:NH4HSO4或(NH4)2SO4;
③FeSO4与碱反应生成白色沉淀氢氧化亚铁,氢氧化亚铁具有强的还原性,被空气中氧气氧化生成氢氧化铁,所以看到现象白色沉淀迅速变灰绿色沉淀,过一段时间后变成红褐色,化学方程式:Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+和4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,是因氨在水中存在平衡为NH3+H2O NH3•H2O
NH3•H2O NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除,
NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除,
故答案为:氨在水中存在平衡为NH3+H2O NH3•H2O
NH3•H2O NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;
NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;
(4)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水,该反应为2NH3+3O2$\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O,由反应可知,生成2molHNO2时转移2mol×[3-(-3)]=12mol电子,则有0.3mol电子发生转移时,生成亚硝酸0.3mol×$\frac{2}{12}$=0.05mol,其质量为0.05mol×47g/mol=2.35 g,
故答案为:2NH3+3O2$\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O;2.35.
点评 本题以氨气的性质考查物质之间的反应,涉及氧化还原反应、平衡移动原理、非金属性比较等,综合性较强,侧重学生分析能力和计算能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Al2O3、NaHCO3均可与强酸、强碱反应,都为两性物质 | |
| B. | Na2O2、AlCl3在适当条件下均可导电,都为电解质 | |
| C. | CuCl2与FeCl3均可与Fe发生置换反应,都可充当氧化剂 | |
| D. | BaCO3、BaSO4、Ba(OH)2均难溶于水,所以均属于难溶电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.
实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和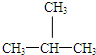
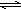 HCO3-+OH-
HCO3-+OH- 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的PH | 3.2 | 8.8 | 5.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验使用的主要仪器是分液漏斗 | |
| B. | 溶质溶于萃取剂中所得的溶液不一定有颜色 | |
| C. | 溶质在萃取剂中的溶解度比在原溶剂中的溶解度大 | |
| D. | CCl4、苯、汽油、酒精均可萃取碘水中的碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com