
| 5ab |
| 2×25 |
| 5ab |
| 2×25 |
| 0.025ab×126 |
| W |
| 63ab |
| 20W |
| 63ab |
| 20W |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3×6.02×1023 |
| B、1L0.5mol/L的CH3COONa溶液中含有的CH3COO-数为0.5×6.02×1023 |
| C、常温常压下,16g14CH4所含中子数为8×6.02×1023 |
| D、1molCl2发生反应时,转移的电子数一定是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物中含有碳碳双键 |
| B、该有机物属于芳香烃 |
| C、该有机物分子含有碳碳叁键 |
| D、该有机物具有三维空间的立体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知,现使用1 mol/L KI溶液、0.1 mol/L硫酸和淀粉溶液探究溶液出现蓝色的时间与温度的关系,应先将1 mol/L KI溶液、0.1 mol/L硫酸混合,升温后再加入淀粉溶液 |
| B、将稀氯化铁溶液和稀硫氰化钾溶液混合,溶液呈浅红色,无论向其中加入浓氯化铁溶液还是浓硫氰化钾溶液,红色都会加深 |
| C、向0.1 mol/L的醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体生成 |
| D、实验测定酸碱滴定曲线时.要保证整个过程测试和记录pH的间隔相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.| 盐酸 |
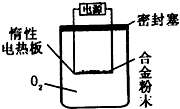
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向明矾溶液中加入等物质的量的Ba(OH)2溶液Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B、向Fe2(SO4)3溶液中通入足量的H2S:Fe3++H2S=Fe2++S↓+2H+ |
| C、向硝酸银溶液中滴加过量氨水:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、含等物质的量的硫酸氢铵与氢氧化钠两种溶液混合:NH4++HSO4-+2OH-=SO42-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A. | CO | CO2 | 通过足量氢氧化钠溶液,并干燥 |
| B. | H2 | 水蒸气 | 通过盛有浓硫酸的洗气瓶 |
| C. | N2 | O2 | 通过炽热的木炭 |
| D. | NaOH溶液 | Na2CO3 | 加入足量稀盐酸至不再产生气泡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com