
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是 ( )
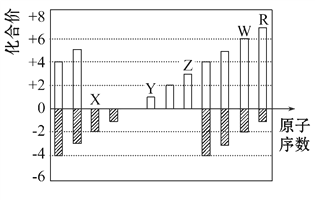
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性: W>R
C. WX3和水反应形成的化合物的是H2WO3
D. Y和Z两者最高价氧化物对应的水化物能相互反应
科目:高中化学 来源: 题型:
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、A12O3和Fe2O3等,回收其中镁的工艺流程如下:

沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH 由见上表
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_____________________(要求写出两条)
(2)滤渣I的主要成分有_________________________。
(3)从滤液II中可回收利用的主要物质有________________________。
(4)若最终得到的氯化镁溶液中,c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1 ,此时是否有Mg3(PO4)2沉淀生成?_______(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(5) Mg (C1O3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl已知四种化合物的溶解度(S) 随温度(T) 变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg (ClO3)2。简述可制备Mg (ClO3)2的原因:_______________________。
②按①中条件进行制备实验。在冷却降温析出Mg (ClO3)2过程中,常伴有NaCl 析出,原因是:__________。除去产品中该杂质的方法是:___________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂。有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水.易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水。 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
实验室可以用多种方法来制备无水FeCl2,回答下列问题:
I.按如图l装置用H2还原无水FeCl3制取,装置C的作用是_________;E中盛放的试剂是_________;D中反应的化学方程式为_________。

II.按如图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128—139℃加热3h,反应接近100%。冷却,分离提纯得到粗产品。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HC1
(1)该制取反应中,作还原剂的是_________。
(2)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是_________。
(3)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。
①洗涤所用的试剂可以是_________;
②回收滤液中C6H5Cl的方法是_________。
(4)仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中试剂可以是加有酚酞,且理论上含_________g NaOH的溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国、荷兰的三位科学家获得,表彰他们在“分子机器的设计与合成”做出的贡献。下列物质由分子构成且属于电解质的是
A.H2SO4 B.NaCl C.NH3 D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。
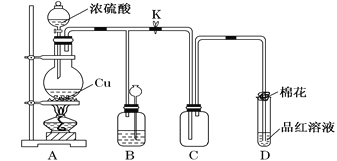
(1)装置A中发生反应的化学方程式为_____________________________________
(2)装置D中试管口放置的棉花应浸一种溶液,这种溶液是________,其作用是____________________________________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_______________________,B中应放置的溶液是________。
a.水 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是燃烧和代谢的最终产物,也是造成温室效应的废气,但CO2作为一种资源,开发和利用的前景十分诱人。
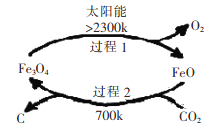
I、利用太阳能,以CO2为原料制取炭黑的流程如上图所示。过程2的化学方程式为:__________。
II、近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应制取甲醇。其工艺流程如图所示:

(1)①由吸收池导入分解池中的主要物质的化学式是____________。
②上述流程中____________(填化学式)可循环使用,该流程体现了“绿色化学”理念。
(2)不同温度下,在1L恒容密闭容器中充入2mol CO2和5 mol H2,相同时间内测得CO2的转化率随温度变化如下图所示:

①合成塔中发生的化学反应方程式为____________。
②T1时a点v(正)____________v(逆)(填“>”,“<”,“=”)
③计算温度为T4时b的平衡常数为____________。
(3)为检验吸收池中饱和K2CO3溶液是否充足,量取l00mL吸收液用0.10 mol./L盐酸滴定,生成的V(CO2)(标准状况下)随V(盐酸)变化关系如图所示:

则该l00mL吸收液还可吸收标准状况下_______mLCO2.
III、以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将CO2转化为低碳烯烃,工作原理如右图所示。

(1)H+的移动方向是_______________(填从左至右或从右至左);
(2)产生乙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某lL混合溶液中所含离子的个数比如下表,则M离子可能为( )
所含离子 | NO3- | SO42- | H+ | M |
个数比 | 2 | 1 | 2 | 1 |
A.Mg2+B.Ba2+C.F-D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:LaCl3+6NH4HCO3= La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。

(1)盛放稀盐酸的仪器为__________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→ → → → → 。_____________
(3)Y中发生反应的化学反应式为____________________________________。
(4)X中盛放的试剂是____________,其作用为___________________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________________________。
(6)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mL NH3-NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 mol·L-1 EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La 3++H2Y2-= LaY-+2H+),消耗EDTA溶液44.0 mL。则产品中La2(CO3)3的质量分数w[La2(CO3)3]=________________。
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为__________;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示。在t1 min之后固体质量增加的原因可能是_______________。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com