
Ⅰ. (6分)下列描述中正确的是( )
A. CS2为V形的极性分子
B. ![]() 的空间构型为平面三角形
的空间构型为平面三角形
C. SF6中有6对完全相同的成键电子对
D. SiF4和![]() 的中心原子均为sp3杂化
的中心原子均为sp3杂化
Ⅱ. (14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为__________________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,![]() 和
和![]() 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
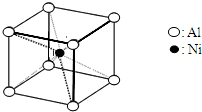
(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________;
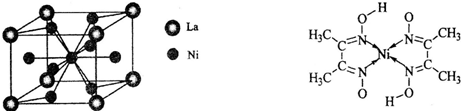
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________;

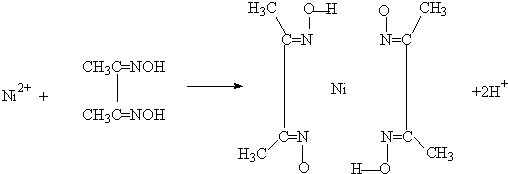
(5)丁二酮肟常用于检验![]() :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与![]() 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________;
②该结构中,氧氢之间除共价键外还可存在_________________键;
③该结构中,碳原子的杂化轨道类型有_________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com