
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:_________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)将足量的GD2通入EDA溶液中所得溶液的离子浓度的大小顺序为:
(1)非极性共价键、离子键
(2)N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol 三角锥形 sp3杂化
2NH3(g);△H=-92.2kJ/mol 三角锥形 sp3杂化
(3)Na3N + 4H2O=3NaOH + NH3·H2O
(4)1s22s22p63s23p63d104s1 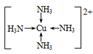 有深蓝色晶体析出
有深蓝色晶体析出
(5)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
解析试题分析:根据题干信息:A是氢、B是碳、C是氮、D是氧、E是钠、F是铝、G是硫、H是铜。
(1)Na2O2中含有非极性共价键和离子键。
(2)信息表示合成氨的热化学方程式。
(3)Na3N能与水反应生成两种的碱NaOH和NH3·H2O
(4)Cu离子可以与水形成四水合铜配合物。
(4)将足量的SO2通入NaOH溶液中所得溶液为NaHSO3溶液,HSO3- H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O H2SO3+OH-,HSO3-电离的程度大于水解的程度,溶液呈酸性,溶液中各离子间的关系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
H2SO3+OH-,HSO3-电离的程度大于水解的程度,溶液呈酸性,溶液中各离子间的关系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
考点:本题考查了元素化合物的知识,有物质的推导,热化学方程式的书写。


科目:高中化学 来源: 题型:填空题
下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA3型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。据此回答下列问题:
(1)D元素在元素周期表中的位置是 。
(2)B与D所形成的化合物电子式为 。
(3)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,产生淡黄色沉淀,其反应的化学方程式为 。
(4)实验室里除去BA2气体,可用下列试剂中的 (填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.品红溶液
(5)由A、B、D三种元素所组成的某种盐水溶液显碱性,其原因是 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是常见的非金属元素,主要以钠盐的形式存在于海水中。
(1)Y在元素周期表中的位置是________;X氢化物的电子式为_________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈_______(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是________。
(3)Y-Ag2O电池是应用广泛的鱼雷电池,其原理如下图所示。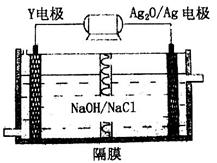
该电池的负极反应式是________。
(4)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是_________
(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| | Q | R | |
| T | | | W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出元素名称:C 、D 、E 。
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,B的最简单气态氢化物的电子式为____________,BC2分子的结构式是 ______________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 。 (4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的特征电子构型是 ,在元素周期表中位置是 ,其最高价氧化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)X氢化物的电子式是_________________________________________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是_____________________________________.
(3)Y—AgO电池是应用广泛的鱼雷电池,其原理如图所示。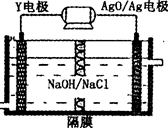
该电池的负极反应式是___________________________________。
(4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据表中信息回答下列问题。
| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
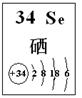
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 | | |
| 3 | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com