
| A. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
分析 A.光比电解消耗的能源少,不会产生污染;
B.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈;
C.聚乙烯塑料很难降解,聚乳酸塑料易降解;
D.合金就是某种金属与其他一种或几种金属或非金属融合在一起形成的混合物.
解答 解:A.光催化更环保经济,电解需耗费大量能源,故A正确;
B.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈,故B正确;
C.聚乙烯塑料难降解,可造成白色污染,聚乳酸塑料易降解不会造成白色污染,故C错误;
D.“不锈钢是合金”,不锈钢是铁、钴、镍的合金,故D正确;
故选C.
点评 本题考查合金、金属的腐蚀与防护、新能源的开发与利用,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.


科目:高中化学 来源: 题型:解答题
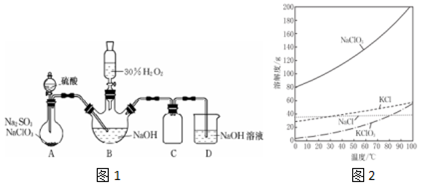
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 符合的条件 | 序号 |
| 1 | 电解质 | |
| 2 | 非电解质 | |
| 3 | 强电解质 | |
| 4 | 弱电解质 | |
| 5 | 既不是电解质也不非电解质 | |
| 6 | 能导电的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7gAl原子变成离子时,失去电子数为0.1NA | |
| B. | 22.4LCH4 所含的电子数为10NA | |
| C. | 20℃1.01×105Pa时,28gN2所含的原子为NA | |
| D. | 20℃1.01×105Pa时,11.2LO2所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH4 | |
| B. | 存在于污水中的细菌,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO═3Mg+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由 Al、Cu、稀 H2SO4 组成原电池,放电时 SO42-向 Al 电极移动 | |
| B. | 由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由 Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出 1 mol Ag时,消耗铜电极32 g | |
| D. | 由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
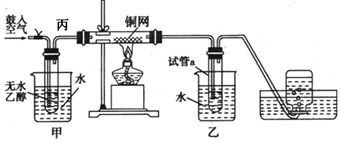
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com