
【题目】镁的单质及其化合物在储氢及大气治理等方面用途非常广泛。
I.工业上可以采用热还原法制备金属镁(沸点1107℃,熔点648.8℃)。 将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先 升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体)。
(1)用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是____________。
(2)碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:_____________。

II.工业上利用纳米MgH2和LiBH4组成的体系储放氢(如题图所示)。

(3)写出放氢过程中发生反应的化学方程式:___________。
III.工业上MgO浆液是高活性的脱硫剂,常用来脱除烟气中的SO2。主要包含的反应有: ① Mg(OH)2+ SO2=MgSO3+H2O ② MgSO3+SO2+H2O= Mg(HSO3)2 ③ Mg(HSO3)2+ Mg(OH)2=2MgSO3+2H2O ④ 2MgSO3+O2=2MgSO4
脱硫时,MgO的脱硫效率、pH及时间的关系如题图所示。

己知20℃时,H2SO3的K1=l.54×10-2,K2=1.02×10-7,25℃时,Ksp[MgSO3]= 3.86×10-3,Ksp(CaSO3)= 3.1×10-7。
(4)脱硫过程中使浆液pH减小最显著的反应是______________(填①、②、③或④)。
(5)约9000s之后,脱硫效率开始急速降低,其原因是______________。
(6)其他条件相同时,镁基和钙基脱硫效率与液、气摩尔流量比如题图所示。镁基脱硫效率总比钙基大,除生成的MgSO4具有良好的水溶性外,还因为______________。

【答案】 在空气中镁被氧气氧化 MgO+C ==== Mg+CO↑ MgH2+2LiBH4 =2LiH+MgB2+4H2 ↑ ① ② 浆液中Mg(OH)2已耗尽 MgSO3溶解度比CaSO3大,MgSO3比CaSO3更易被氧化
【解析】本题主要考查镁的单质及其化合物的性质。
I.(1)用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是在空气中镁被氧气氧化。
(2)碱式碳酸镁分解最终得到MgO,在1450℃反应制得镁的化学方程式:MgO+C ==== Mg+CO↑。
II.(3)放氢过程中发生反应的化学方程式:MgH2+2LiBH4 =2LiH+MgB2+4H2 ↑。
III.(4)脱硫过程中反应①消耗碱Mg(OH)2,反应②生成能电离产生H+的酸式盐Mg(HSO3)2,所以使浆液pH减小最显著的反应是①②。
(5)约9000s之后,脱硫效率开始急速降低,其原因是浆液中Mg(OH)2已耗尽 。
(6)镁基脱硫效率总比钙基大,除生成的MgSO4具有良好的水溶性外,还因为MgSO3溶解度比CaSO3大,MgSO3比CaSO3更易被氧化。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 二氧化硅是酸性氧化物,不与任何酸反应
B. 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强
C. SiO2晶体中,每个硅原子与两个氧原子相连
D. 工业上制玻璃的主要原料有:黏土、石灰石、石英
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C是地壳中含量最多的元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.
请回答:
(1)由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物的水溶液充分反应的化学方程式为____________。
(2)单质B与A2C在一定条件下发生反应,工业上用于制水煤气、利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) ![]() CH3OH(g) ΔH=-90.8 kJ·mol-1
CH3OH(g) ΔH=-90.8 kJ·mol-1
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
请写出由水煤气合成二甲醚的总反应的热化学方程式:__________ 。
(3)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,有关零排放车载燃料电池叙述正确的是( ) 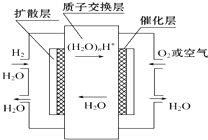
A.正极通入H2 , 发生还原反应
B.负极通入H2 , 发生还原反应
C.总反应式为2H2+O2=2H2O
D.导电离子为质子,且在电池内部由正极定向移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 常温常压下,1 g H2在足量Cl2中燃烧生成HCl,放出92.3 kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)2HCl(g) ΔH=+184.6 kJ·mol-1
B. 甲烷的标准燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D. 相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ΔH大于0表示吸热反应;ΔH小于0表示放热反应。关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学机理为:①HUr(尿酸)+H2O![]() Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+(aq)
Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+(aq)![]() NaUr(s)下列对反应②的叙述中正确的是( )
NaUr(s)下列对反应②的叙述中正确的是( )
A. 反应的ΔH>0 B. 降低温度,平衡向逆反应方向移动
C. 反应的ΔH<0 D. 升高温度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。
(1)装置A中NaClO3和Na2SO3制备ClO2气体,其物质的量的理论比值为____________;该装置中采用浓硫酸而不用稀硫酸的原因是___________。
(2)装置B的作用是 _____________;装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是________________。
(3)写出装置C发生的离子方程式______________。
(4)从装置C反应后的溶液获得干燥的NaClO2晶体的操作步骤为:将装置C中的液体取出在减压和55℃条件下蒸发,至出现大量晶体后,___________________(填实验步骤)。(已知:NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,不能说明反应:C(s) +CO2(g)![]() 2CO(g)已达到平衡状态的是
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )

A. 途径①的反应中体现了浓HNO3的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大O2的浓度来低成本
C. 由途径①、②、③分别制取1molH2SO4,理论上各消耗1molS,各转移6mole-
D. 途径②、③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理论
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com