
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学反应中的能量变化通常表现为热量的变化 | |
| C. | 化学反应中能量变化的大小与反应物的质量密切相关 | |
| D. | 化学键的断裂和形成是化学反应中能量变化的主要原因 |
分析 A、反应吸热还是放热与反应条件无关,决定于反应物和生成物的能量高低;
B、化学反应中的能量变化形式包括热能、电能、光能等等,主要是热能;
C、化学反应过程中能量变化是化学反应的基本特征,能量变化的大小与反应物的质量有关系;
D、化学反应的过程就是旧键断裂和新键形成的过程.
解答 解:A、需要加热才能发生的反应不一定是吸热的,如燃烧都是放热的,需要加热到着火点,故A错误;
B、能量变化形式包括热能、电能、光能等等,主要是热能,故B正确;
C、任何化学反应都有能量变化,能量变化是化学反应的基本特征之一,化学反应中能量变化的大小与反应物的质量成正比关系,故C正确;
D、旧键断裂需要吸收能量,新键形成能够释放能量,化学键的断裂和形成是化学反应中能量变化的主要原因,故D正确.
故选:A.
点评 本题考查焓变的原因和形式以及与反应条件无关相关知识点,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | M的分子式为C13H18O3 | |
| B. | M一定条件下,可以发生加成、酯化、水解等反应 | |
| C. | 1mol M与足量金属钠反应,可生成标准状况下的H211.2 L | |
| D. | 1mol M最多能与4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
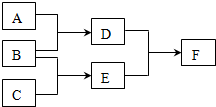 现有A、B、C、D、E、F六种中学化学中常见的物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如下(反应条件已略去):
现有A、B、C、D、E、F六种中学化学中常见的物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如下(反应条件已略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
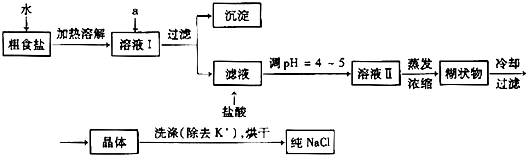
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸常显黄色的原因是浓硝酸中溶有少量NO2 | |
| B. | 氯水和二氧化硫都能使品红溶液褪色 | |
| C. | 漂白粉长期暴露在空气中会变质 | |
| D. | 蔗糖中加入浓硫酸固体颜色变黑,说明浓硫酸具有吸水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com