解:(1)铁先被硝酸氧化为Fe
3+,硝酸反应完毕,铁与Fe
3+反应生成Fe
2+,当Fe
3+反应完毕,铁再与H
+反应生成亚铁离子与氢气.由图象可知,由于铁过量,OA段发生反应为:Fe+NO
3-+4H
+=Fe
3++NO↑+2H
2O,AB段发生反应为:Fe+2Fe
3+=3Fe
2+,BC段发生反应为:Fe+2H
+=Fe
2++H
2↑.
故答案为:Fe+NO
3-+4H
+=Fe
3++NO↑+2H
2O;Fe+2Fe
3+=3Fe
2+;Fe+2H
+=Fe
2++H
2↑.
(2)由图可知生成的NO的物质的量为0.2mol,OA段发生反应为:Fe+NO
3-+4H
+=Fe
3++NO↑+2H
2O,硝酸全部起氧化剂作用,根据氮元素守恒可知溶液中硝酸的物质的量为0.3mol,故硝酸的物质的量浓度为
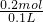
=2mol/L;
由图可知,加入22.4g铁时,溶液中剩余的硫酸完全反应,此时溶液中溶质为硫酸亚铁,铁的物质的量为
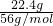
=0.4mol,根据碳元素守恒可知硫酸亚铁的物质的量为0.4mol,根据硫元素守恒计算硫酸的物质的量为0.4mol,故硫酸的物质的量浓度为
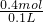
=4mol/L.
答:溶液中硝酸的浓度为2mol/L;硫酸的浓度为4mol/L.
分析:(1)铁先被硝酸氧化为Fe
3+,硝酸反应完毕,铁与Fe
3+反应生成Fe
2+,当Fe
3+反应完毕,铁再与H
+反应生成亚铁离子与氢气.由图象可知,由于铁过量,OA段发生反应为:Fe+NO
3-+4H
+=Fe
3++NO↑+2H
2O,AB段发生反应为:Fe+2Fe
3+=3Fe
2+,BC段发生反应为:Fe+2H
+=Fe
2++H
2↑.
(2)OA段发生反应为:Fe+NO
3-+4H
+=Fe
3++NO↑+2H
2O,由图可知生成的NO的物质的量为0.2mol,硝酸全部起氧化剂作用,根据氮元素守恒计算溶液中硝酸的物质的量,进而根据定义计算硝酸的物质的量浓度;
由图可知,加入22.4g铁时,溶液中剩余的硫酸完全反应,此时溶液中溶质为硫酸亚铁,根据碳元素守恒计算硫酸亚铁的物质的量,再根据硫元素守恒计算硫酸的物质的量,根据定义计算硫酸的物质的量浓度.
点评:本题以图象为载体,考查有关金属和酸反应的计算题,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用.


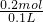 =2mol/L;
=2mol/L;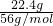 =0.4mol,根据碳元素守恒可知硫酸亚铁的物质的量为0.4mol,根据硫元素守恒计算硫酸的物质的量为0.4mol,故硫酸的物质的量浓度为
=0.4mol,根据碳元素守恒可知硫酸亚铁的物质的量为0.4mol,根据硫元素守恒计算硫酸的物质的量为0.4mol,故硫酸的物质的量浓度为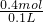 =4mol/L.
=4mol/L.




