
分析 (1)将已知方程式变性运算得到目标方程式,依据盖斯定律计算反应热,标注物质聚集状态和对应反应量的反应热;
(2)使部分H2S燃烧放出热量,为H2S热分解反应提供热量;SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O;
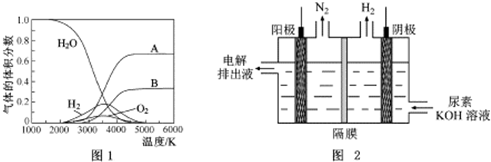
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,据此判断;
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2.
解答 (1):①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O,
反应方程式为2H2S+SO2═2H2O+3S,
故答案为:为H2S热分解反应提供热量;2H2S+SO2═2H2O+3S;
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢气、B为氧气,
故答案为:氢气、氧气;
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2,
故答案为:2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2.
点评 本题为综合题,涉及热化学方程式的书写、化学方程式的书写、电极反应式的书写,熟悉盖斯定律计算反应热的方法、明确电解池工作原理、物质的性质是解题关键,题目难度中等.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A→B的反应类型:加成反应
A→B的反应类型:加成反应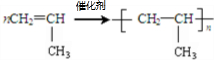 ;
;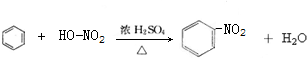 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应比金属钠与甲醇反应更剧烈 | |
| B. | 结合H+的能力CH3O-<OH- | |
| C. | 所得到溶液中K=c(CH3O-)×c(CH3OH2+) | |
| D. | 所得到溶液中c(Na+)+c(CH3OH2+)═c(CH3O-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,等浓度的H2SO4和CH3COOH溶液中的c(H+) | |
| B. | 相同温度下,等浓度的Ba(OH)2和NaOH溶液,前者与后者的c(OH-) | |
| C. | 相同温度下,0.2 mol•L-1醋酸溶液和0.1 mol•L-1醋酸溶液中的c(H+) | |
| D. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
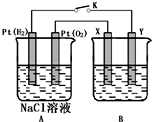 某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
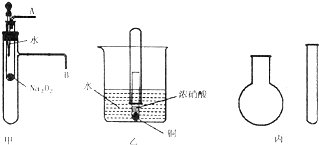 “套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com