
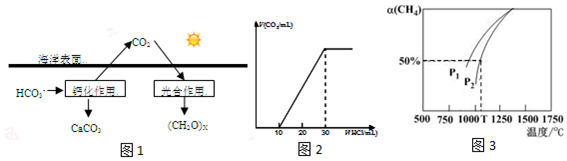
分析 (1)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
(2)①二氧化碳溶于水生成碳酸,碳酸为弱酸,部分电离生成碳酸氢根;
②由图可知:此过程碳酸氢根转化生成碳酸钙,据此书写方程式;
(3)①CO2+H2O?H2CO3 K=1.8×10-3
②H2CO3?H++HCO3- Ka1=4.3×10-7,
K1=$\frac{c({H}_{2}C{O}_{3})}{c(C{O}_{2})}$=1.8×10-3,
K2=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=4.3×10-7,
K1×K2=$\frac{{c}^{2}({H}^{+})}{c(C{O}_{2})}$=1.8×10-3×4.3×10-7,
计算得到c(CO2);
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用 N2吹出CO2,再用NaOH溶液吸收,图象分析可知,生成碳酸钠和碳酸氢钠溶液,碳酸钠和碳酸氢钠物质的量之比为1:1,生成二氧化碳气体消耗盐酸体积20ml,依据原理NaHCO3+HCl=NaCl+CO2↑+H2O解答即可;
(5)该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;根据转化率计算平衡时各物质的平衡浓度,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到平衡常数;
解答 解:(1)①2NH3(g)+CO2(g)→NH2CO2 NH4(s)-l59.47kJ•mol-1
②NH2CO2NH4(s)→CO(NH2)2(s)+H2O(g)+116.49kJ•mol-1
③H2O(l)→H2O(g)+88.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98KJ/mol;
(2)①二氧化碳溶于水生成的碳酸为弱酸,部分电离生成碳酸氢根,有关方程式为:CO2+H2O?H2CO3,H2CO3?H++HCO3-,溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、HCO3-、CO32-,
故答案为:HCO3-、CO32-;
②反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:
2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O,
故答案为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O;
(3)①CO2+H2O?H2CO3 K=1.8×10-3
②H2CO3?H++HCO3- Ka1=4.3×10-7,
K1=$\frac{c({H}_{2}C{O}_{3})}{c(C{O}_{2})}$=1.8×10-3,
K2=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=4.3×10-7,
K1×K2=$\frac{{c}^{2}({H}^{+})}{c(C{O}_{2})}$=1.8×10-3×4.3×10-7,
c(CO2)=$\frac{(1{0}^{-8})^{2}}{1.8×1{0}^{-3}×4.3×1{0}^{-7}}$=1.3×10-7mol/L,
故答案为:1.3×10-7mol/L;
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用 N2吹出CO2,再用NaOH溶液吸收,图象分析可知,生成碳酸氢钠溶液和碳酸钠溶液,二者物质的量之比为1:1,溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),Na2CO3+HCl=NaHCO3+NaCl,生成二氧化碳气体消耗盐酸体积20ml,此反应原理为:NaHCO3+HCl=NaCl+CO2↑+H2O,即碳酸氢钠与盐酸的物质的量之比为1:1,那么海水中碳酸氢钠的浓度为c,体积均为100mL,则c=$\frac{0.02L×1mol/L}{0.1L}$=0.2mol/L,
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);0.2;
(5)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2,压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
在Y点对应温度下的甲烷的平衡转化率为50%,则
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始(mol/L) 0.1 0.1 0 0
转化(mol/L)0.05 0.05 0.1 0.1
平衡(mol/L)0.05 0.05 0.1 0.1
所以平衡常数Kp=$\frac{(3×\frac{0.1}{0.3})^{2}(3×\frac{0.1}{0.3})^{2}}{(3×\frac{0.05}{0.3})×(3×\frac{0.05}{0.3})}$=4;
故答案为:<;4.
点评 本题考查了化学平衡常数的计算、盖斯定律的应用、平衡的移动、离子浓度大小比较等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 温度升高,水中分子总数减少 | B. | 水中c(OH-)随温度升高而降低 | ||
| C. | 水的pH随温度升高而升高 | D. | 水的电离过程是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过干馏可将煤中含有的苯、甲苯等物质分离出来 | |
| B. | 有机玻璃、聚酯纤维(涤纶)均由加聚反应生成 | |
| C. | 地沟油制得的生物柴油和裂化汽油都是烃 | |
| D. | 乙烯与氧气生成环氧乙烷原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
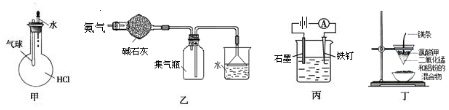
| A. | 如图装置甲:验证HCl气体在水中的溶解度大 | |
| B. | 如图装置乙:可干燥、收集氨气,并吸收多余的氨 | |
| C. | 如图装置丙:防止铁钉生锈 | |
| D. | 如图装置:可制得金属锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
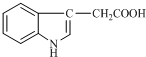 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸的分子式是C10H10NO2 | |
| B. | 吲哚乙酸苯环上的二氯代物共有四种(不考虑立体异构) | |
| C. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 | |
| D. | 1 mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用植物秸秆可以生产香料乙酸乙酯 | |
| B. | 从煤焦油中提取苯和苯的同系物,可采取的方法是萃取 | |
| C. | 用石油裂解产物通过加聚反应直接制备PVC(聚氯乙烯) | |
| D. | 油脂在氢氧化钠溶液中加热发生皂化反应,最终生成高级脂肪酸和丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe(OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加入H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ③>①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com