
| A. | 无色,透明,稳定的液体都是溶液 | |
| B. | 悬浊液和乳浊液不稳定,可以放置一段时间后分别用过滤和分液的方法分离. | |
| C. | 胶体区别于其它分散系的本质特征是丁达尔现象 | |
| D. | 电泳现象是胶体特有的一种性质 |
分析 A、溶液和胶体均可以是无色、稳定、透明的;
B、固体小颗粒分散在分散剂中为悬浊液;小液滴分散在分散剂中为乳浊液;
C、胶体、溶液和浊液的本质区别是分散质粒子直径的大小;
D、只要是粒子带电,均能发生电泳.
解答 解:A、溶液和胶体均可以是无色、稳定、透明的,故无色、透明和稳定的不一定是溶液,还可能是胶体,故A错误;
B、固体小颗粒分散在分散剂中为悬浊液,故可以用过滤的方法分离;小液滴分散在分散剂中为乳浊液,故可以用分液的方法来分离,故B正确;
C、胶体、溶液和浊液的本质区别是分散质粒子直径的大小,而不是丁达尔效应,故C错误;
D、只要是粒子带电,均能发生电泳,故胶体和溶液均可能发生电泳,故D错误.
故选B.
点评 本题考查了胶体和其它分散系的本质区别以及胶体的特有性质,应注意的是胶体的本质区别是分散质粒子直径大小,而特有性质是丁达尔效应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 加入硫酸铜 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.8 mol•L-1•s-1 | B. | v(A2)=40 mol•L-1•min-1 | ||
| C. | v(AB3)=1.0 mol•L-1•s-1 | D. | v(B2)=1.2 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
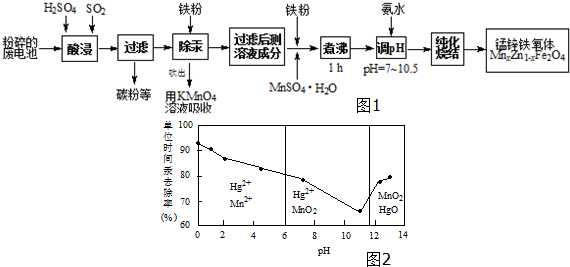
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K、Rb的沸点逐渐降低 | |
| B. | 与硅相比,金刚石的硬度大、熔点高 | |
| C. | HF、HCl、HBr、HI热稳定性依次减弱 | |
| D. | H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com