
| A. | 热稳定性:H2O>HF>H2S | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 原子半径:Na>Mg>O | D. | 氧化性:N2>Br2>Cl2 |
分析 A.非金属性越强,氢化物越稳定;
B.非金属性越强,最高价氧化物的水化物酸性越强;
C.电子层越多,原子半径越大,同周期原子序数大的原子半径小;
D.同主族,从上到下非金属性减弱.
解答 解:A.非金属性F>O>S,热稳定性:HF>H2O>H2S,故A错误;
B.非金属性Cl>S>P,最高价氧化物的水化物酸性为H3PO4<H2SO4<HClO4,故B错误;
C.电子层越多,原子半径越大,同周期原子序数大的原子半径小,则原子半径为Na>Mg>O,故C正确;
D.同主族,从上到下非金属性减弱,氮气性质稳定,则氧化性为N2<Br2<Cl2,故D错误;
故选C.
点评 本题考查非金属性的性质,为高频考点,把握元素的位置、性质及元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
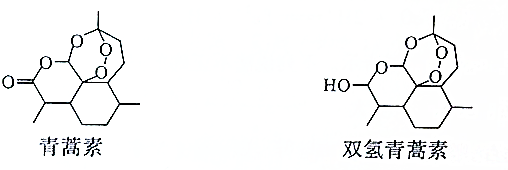
| A. | 双氢青篙素属于脂类物质 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素环上的一氯取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
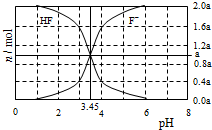 25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是
25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是| A. | pH=3时,溶液中:c(Na+)<c(F一) | |
| B. | c(F一)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2amol•L-1 | |
| D. | pH=3.45时,NaOH溶液恰好与HF完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化铝溶液中加入过量氨水:氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氨气通入醋酸溶液中:NH3+CH3COOH═CH3COO+NH4+ | |
| C. | 氯化铁溶液中加入铁粉:Fe+2FeCl3═2Fe+3Cl- | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);
室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E从HE的溶液中置换出来 | |
| B. | 气态氢化物的稳定性:D>A>B | |
| C. | 离子半径由大到小的顺序是A>J>H | |
| D. | 最高价氧化物的水化物的碱性:H>I>J |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y | |
| C. | W的简单氢化物稳定性比Z的简单氢化物稳定性低 | |
| D. | Y与W形成的化合物YW2的熔点高、硬度大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com