
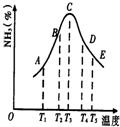
 在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:
在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:| 7 | 8 |
| 7 |
| 8 |
| 7 |
| 8 |
| 1-x+3-3x+ 2x |
| 1+3 |
| 7 |
| 8 |
| 1mol |
| 0.25mol |
| Q |
| 23.1kJ |


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(带解析) 题型:填空题
(18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有 (填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
查看答案和解析>>
科目:高中化学 来源:2014届山东省济宁市高二12月质量检测化学试卷(解析版) 题型:填空题
(18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:

(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有 (填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.吸收NH3 G.通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2![]() 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系
压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式
为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3
产率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强 D 减小压强
E 加入催化剂 F 吸收NH3 G 通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com