
【题目】写出下列物质的电子式:
(1)Cl2____________ (2)N2___________ (3)H2O___________
(4)NaOH __________(5)CH4___________ (6)CO2__________ 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________kJ/mol。
II.对于反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为![]() ,则反应的平衡常数K=______。
,则反应的平衡常数K=______。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是______,500K时p(CO)随时间变化关系的曲线是_______。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于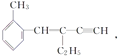 ,下列结论正确的是( )
,下列结论正确的是( )
A. 该有机物分子式为C13H16 B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线 D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )
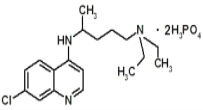
A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从某烃A合成一种染料中间体DSD酸。(试剂和条件已略去)
A![]() B
B![]() CD
CD
已知:
①B的结构简式为![]()
②![]()
![]()
![]()
③![]()
![]()
![]() (-NH2易被NaClO氧化)
(-NH2易被NaClO氧化)
④2![]()
![]()

请回答下列问题
(1)A的结构简式_____________________________________;
(2)C的结构简式_____________________________________;
(3)D的结构简式_____________________________________。
(4)A到B的反应方程式为_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O ,相对分子质量为288)易溶于水,是一种很好的补铁剂,可由乳酸[CH3CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如图所示)
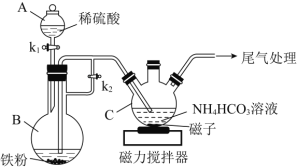
(1)实验操作如下:打开______,加入适量稀硫酸后关闭k1,使反应进行一段时间,其目的除生成FeSO4溶液外,还有__________________________________。
(2)接下来使仪器C中的制备反应发生,其反应的离子方程式为_____________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是_____。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在__________________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于100%,其原因可能是____________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成100mL溶液。吸取 25.00mL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000 mol·L-1硫代硫酸钠溶液滴定(已知:I2 + 2S2O![]() =S4O
=S4O![]() + 2I-),当溶液_____________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_____________%。
+ 2I-),当溶液_____________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_____________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com