
| A.巴尔末 | B.巴特列 | C.洪特 | D.范德华 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:不详 题型:问答题
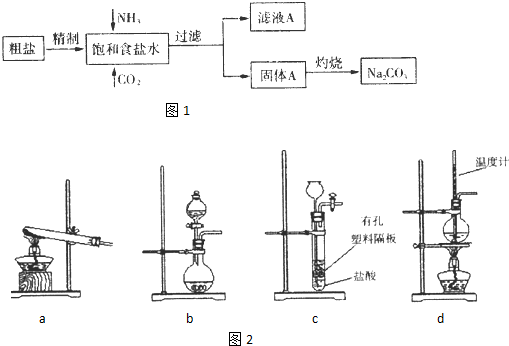
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
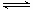 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1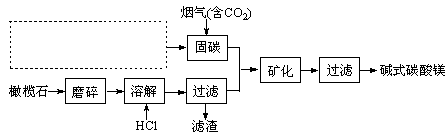
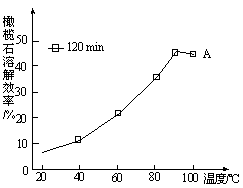
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量少,速度快 |
| B.1H核磁共振谱能反映出有机物中不同环境氢原子的种数和个数 |
| C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团 |
| D.同位素示踪法可以用来确定有机反应中化学键的断裂位置 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
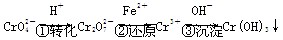
 Cr2O(橙色)+H2O
Cr2O(橙色)+H2O Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 以上反应中,最节能的是 ,原子利用率最高的是 。
以上反应中,最节能的是 ,原子利用率最高的是 。
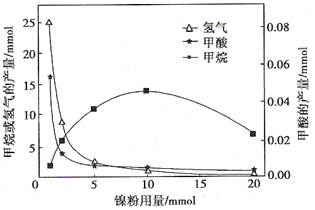

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com