
| A�� | ����ȼ�����п��ܳ�Ϊ����δ������Ҫ��Դ | |
| B�� | ����ȼ������һ�ֱȽϽྻ����Դ | |
| C�� | ����ȼ�����ṩ��ˮ���ܱ���͵���֤ | |
| D�� | ����ȼ��������Ҫ��ȼ�ɷ��Ǽ��� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| Ka | Ka2 | |
| H2S03 | 1.3��10-2 | 6.3��10-8 |
| H2C03 | 4.2��10-7 | 5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ij��Һ�еμ���ˮ���ٵμ�KSCN��Һ������Һ���Ѫ��ɫ����ԭ��Һ��һ����Fe2+ | |
| B�� | ��Ԫ����ɫ��Ӧ�IJ����ǣ�����˿����ϡ������ϴ�Ӻ���������ɫ��Ȼ�����ò�˿պȡ�����Ȼ��أ��������գ�ֱ�ӹ۲������ɫ | |
| C�� | ��ij��Һ�еμ��Ȼ�����Һ��������ɫ�������ٵμ�����ϡ���ᣬ��Ȼ�а�ɫ���壬˵��ԭ��Һ����SO42- | |
| D�� | ��ij��ɫ��Һ�м��������Һ������Һ����ɫ����ԭ��Һ�к���I2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH��Һ�����ᡢ���� | B�� | ���ᡢNaOH��Һ������ | ||
| C�� | NaOH��Һ�����ᡢCO2 | D�� | ˮ�����ᡢNaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2��CaO����HCl | B�� | MgO��Al2O3����NaOH | C�� | CO2��SO2����Ca��OH��2 | D�� | NaCl��NH4Cl�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ������ | C�� | Բ����ƿ | D�� | �ƾ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
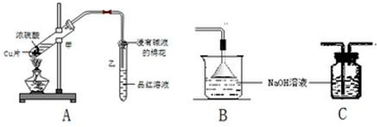
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com