
| A. | K+离子的结构示意图: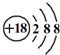 | B. | 乙烯的比例模型: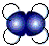 | ||
| C. | H2O2的电子式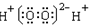 | D. | CH4Si的结构式: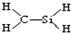 |
分析 A.钾离子的核电荷数为19,不是18;
B.C原子比H原子大,黑色球表示C原子;
C.H2O2为共价化合物,不存在离子;
D.依据乙烯结构推断得到结构式.
解答 解:A.钾离子的核电荷数为19,核外电子总数为18,其正确的离子结构示意图为: ,故A错误;
,故A错误;
B.C原子比H原子大,黑色球表示C原子,则乙烯的比例模型为 ,故B正确;
,故B正确;
C.H2O2为共价化合物,不存在离子,则H2O2的电子式为 ,故C错误;
,故C错误;
D.依据乙烯结构推断得到结构式,CH4Si的结构式 ,故D错误.
,故D错误.
故选B.
点评 本题考查化学用语的表示方法判断,题目难度中等,试题涉及离子结构示意图、比例模型、电子式、结构式等知识,把握化学用语的区别及规范应用为解答的关键,注重基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | 燃烧大块固体燃料 | B. | 把液体燃料雾化后燃烧 | ||
| C. | 燃烧时空气应不足量 | D. | 燃烧时空气应越多越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的单质能从Z的盐溶液中置换出Z | B. | 氢化物的热稳定性:X>W | ||
| C. | Y、Z两元素只能形成阳离子 | D. | 简单离子的半径大小:W>Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
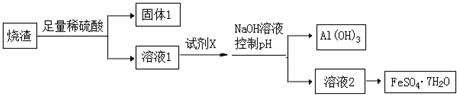
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | CaO量不变 | C. | 氧气压强不变 | D. | CaO2量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
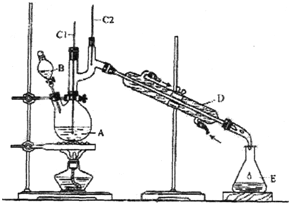 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
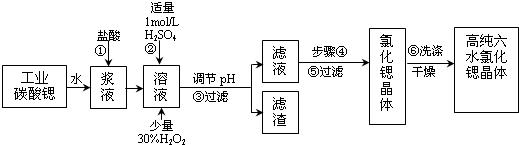
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com