
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+OH- | ||
| C. | PO43-+H2O?HPO42-+OH- | D. | H2O+H2O?H3O++OH- |
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
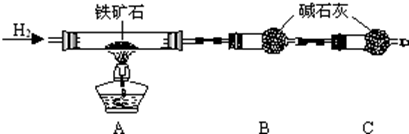
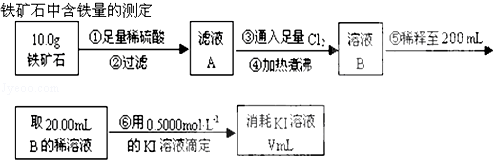
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | LiH、LiD、LiT的摩尔质量之比为8:9:10 | |
| C. | 两原子如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
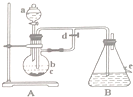 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的CO2通入氨水中:CO2+NH3•H2O═NH4++HCO3- | |
| B. | 除去CO2中的HCl气体:CO32-+2H+═CO2+2H2O | |
| C. | 自然界中溶洞的形成:CaCO3+CO2+2H2O═Ca2++2HCO3- | |
| D. | 用烧碱溶液吸收氯气的反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
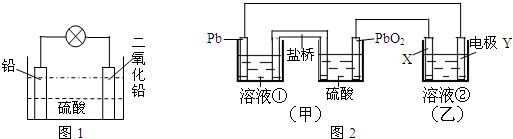
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com