
| A. | 正反应速率减小 | B. | 逆反应速率增大 | ||
| C. | 平均相对分子质量不变 | D. | 转化率增大 |
分析 已知H2的体积分数随温度的升高而增加,说明平衡逆向移动,逆反应是吸热反应,正反应是放热反应,而温度从300℃升至400℃,正逆反应速率都加快,平衡逆向移动,氢气的转化率减小,由此分析解答.
解答 解:A、温度升高正逆反应速率都加快,故A错误;
B、温度升高正逆反应速率都加快,所以逆反应速率增大,故B正确;
C、平衡逆向移动,气体的计量数增加,而气体的质量不变,所以平均相对分子质量变小,故C错误;
D、平衡逆向移动,所以反应物质的转化率减小,故D错误;
故选B.
点评 本题考查化学反应速率的影响以及化学平衡等问题,为高频考点,侧重考查学生的分析能力,注意把握影响反应速率的因素,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 惰性电极电解熔融氯化钠:2Clˉ+2H2O$\frac{\underline{\;电解\;}}{\;}$2OHˉ+H2↑+Cl2↑ | |
| C. | 等体积等物质的度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO32-+NH4+═BaCO3↓+NH3•H2O+H2O | |
| D. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| B. | 手机外壳上铁的碳纤维外模是一种新型的无机非金属材料 | |
| C. | Si常用做信息高速公路的骨架--光导纤维的主要材料 | |
| D. | 浊液、胶体,溶液三种分散系的本质区别是能否产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能使酸性高锰酸钾溶液褪色 | |
| B. | 所有原子都在同一平面上 | |
| C. | 能使溴水褪色 | |
| D. | 与HCl在一定条件下能加成只得到一种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
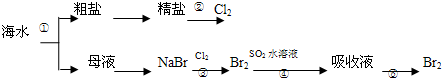
| A. | 上述工艺流程中涉及到化合、分解、复分解和置换反应 | |
| B. | ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2 | |
| C. | ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2 | |
| D. | ④中反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑥⑦ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
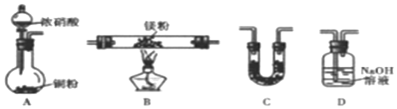
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com