
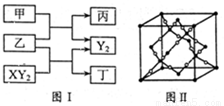
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题:
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中,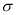 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
(12分,每空2分)
(1)2Na2O2+2H2O==4NaOH+O2↑
(2)sp3 1∶1 24
(3)O>C>H>Na
(4)2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O
【解析】
试题分析:常温下0.01mol/L-1丙溶液PH=12,说明丙为强碱,短周期元素形成,应为NaOH,根据反应框图可知:甲为H2O,乙为Na2O2,XY2为CO2,Y2为O2,丁为Na2CO3,W、X、Y、Z是原子序数依次增大的短周期元素,分别为:H、C、O、Na。
(1)甲为H2O,乙为Na2O2,所以化学方程式为:2Na2O2+2H2O==4NaOH+O2↑
(2)甲的中心原子为O,O形成了2个σ键,还有2对孤对电子,所以杂化方式为sp3;CO2分子结构式为:O=C=O,含有2个σ键和2个π键,所以σ键与π键的数目之比为1:1;根据CO2的原子晶体晶胞图,C分子位于8个顶点,6个面心和4个晶胞内部,则含C原子:8×1/8+6×1/2+4=8,O原子都位于晶胞内部,16个,所以1个晶胞中含有24个原子。
(3)根据H、C、O、Na在元素周期表中的位置可知电负性由大到小的顺序是:O>C>H>Na
(4)次氯酸中Cl元素的化合价为+1,则次氯酸的酸酐为Cl2O,氯气与潮湿的丁反应制备次氯酸的酸酐,同时生成小苏打和食盐混合物,所以化学方程式为:2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O
考点:本题考查元素与物质的推断、杂化轨道和化学键的判断、晶胞的分析、电负性、化学方程式的书写。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:实验题
(7分)用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配制成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还必须用到的仪器有 。
(2)取待测液10.00 mL,用 滴定管量取,并置于锥形瓶中。
(3)向锥形瓶中滴加几滴指示剂,用0.200 mol·L-1标准盐酸滴定待测烧碱溶液。不适宜选用的指示剂为(选填序号):________。①石蕊试液 ②无色酚酞 ③甲基橙试液
(4)根据两次滴定获得的实验数据如下表,得出烧碱的纯度为 。
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是(选填字母) 。
A 酸式滴定管未用盐酸标准溶液润洗就直接注入盐酸标准溶液
B 锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C 装有盐酸标准溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取HCl溶液体积时,开始仰视读数,滴定结束时俯视读数
E.若刚见到指示剂局部的颜色有变化就停止滴定
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
为提纯下列物质(括号内为少量杂质),所选除杂试剂与主要分离方法都正确的是
| 不纯物质 | 除杂试剂 | 分离方法 |
A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
C | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可直接把化学能转化为电能
D.铅蓄电池充电时,阳极的反应为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
前四周期元素X、Y、Z、W、Q的原子序数依次增大。X与Y同周期相邻,Y的基态原子s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的价电子排布为4S1,基态Q原子的未成对电子是同周期元素中最多的。下列说法错误的是
A. 简单气态氢化物的热稳定性:Y>X
B. 简单离子的半径:Z>X>Y
C. Z的最高价氧化物对应水化物既能与强酸反应又能与强碱反应生产盐和水
D. 由Y、W、Q三种元素形成的某种化合物,可用于检查司机酒后驾车
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省眉山市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
将过量的氯气通入30mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3的共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.15 mol
B.当反应中被氧化的氯元素和被还原的氯元素之比为1:4时,溶液中NaClO和NaClO3的物质的量之比为3:1
C.溶液中n(Na+):n(Cl-)可能为7:3
D.若Cl2与NaOH的反应中转移的电子为n mol,则0.15<n<0.35
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
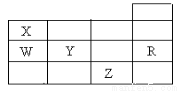
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:选择题
宇航员在升空、返回或遇到紧急情况时,必须穿上10公斤重的舱内航天服,神舟系列宇航员所穿舱内航天服是我国科学家近年来研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅(SiC)、陶瓷和碳纤维复合而成,下列相关叙述错误是( )
A.它耐高温 B.它没有固定熔点
C.它是由多种材料组成的复合材料 D.它是一种新型有机材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com