
【题目】(I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:

(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________,
②既存在离子键又存在极性键的是__________________。
【答案】分液漏斗 a 圆底烧瓶 d CO32-+2H+=H2O+CO2↑ CO2 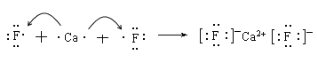
![]() ⑤ ①
⑤ ①
【解析】
(I)比较非金属性的强弱,可根据最高价氧化物的水化物的酸性强弱比较,本题可用稀硫酸与碳酸钠反应验证,C中为澄清石灰水,如变浑浊,则说明生成二氧化碳,可证明硫与碳的得电子能力的强弱;
(II)(1)CaF2是离子化合物,有钙离子和氟离子以离子键结合形成;H2S是共价化合物,有氢原子和硫原子以共价键结合形成;
(2)根据物质的组成和微粒间作用力分析判断各物质的化学键。
(I)(1)比较非金属性的强弱时用的是最高价氧化物的水化物,A仪器名称是分液漏斗,因此在分液漏斗中盛放的是稀硫酸,在圆底烧瓶中盛放的是碳酸盐,答案选a;
(2) B名称是圆底烧瓶,碳酸钙与稀硫酸反应生成的硫酸钙是一种微溶物,会附着在碳酸钙的表面,将阻止反应的进行,所以选取的碳酸钠为反应物,答案选d;
(3)只要证明圆底烧瓶中有二氧化碳生成,就能说明硫酸的酸性比碳酸的酸性强,即说明硫的非金属性比碳强,因此要用澄清石灰水检验二氧化碳的生成,现象是澄清石灰水变浑浊,所以C中试剂是澄清石灰水,B中发生的反应为CO32+2H+═CO2↑+H2O;
(II)(1)CaF2是离子化合物,有钙离子和氟离子以离子键结合形成,形成过程为: ;H2S是共价化合物,有氢原子和硫原子以共价键结合形成,形成过程为:
;H2S是共价化合物,有氢原子和硫原子以共价键结合形成,形成过程为:![]() ;
;
(2)①氢氧化钠中含有钠离子和氢氧根,两种离子间形成离子键,氢氧根中氢原子和氧原子间形成极性共价键,所以氢氧化钠中既存在离子键又存在极性键;
②碘单质为非金属单质,由非金属元素形成的双原子分子,碘原子间形成非极性共价键;
③氯化镁中只含有氯离子和镁离子,只有离子键,不存在共价键;
④过氧化钠中含有钠离子和过氧根离子,过氧根离子中两个氧原子形成非极性共价键,所以过氧化钠中既存在离子键又存在非极性键;
⑤氩气分子为稀有气体单质分子,只存在分子间作用力,不存在化学键;
则不存在化学键的是⑤,既存在离子键又存在极性键的是①。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物G的合成路线如下:
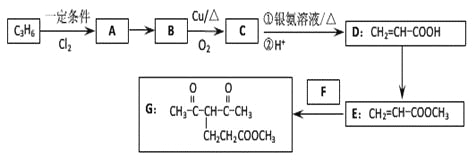
(1)D中含氧官能团的名称为_________,1 molG发生加成反应最多消耗_______mol H2 。
(2)去掉E中含有少量D的试剂和操作是________________________________________;下列有关E的说法正确的是_____________(填字母序号)。
A.可发生氧化反应 | B.催化条件下可发生缩聚反应 |
C.可发生取代反应 | D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式:________________________________________
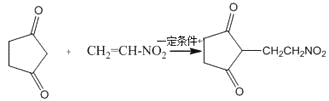
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为______________________。
(5)比G少2个氢原子的物质具有下列性质:任写一种该物质的结构简式_________________。
①遇FeCl3溶液显紫色; ②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗2mol Na和1mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率υ正<υ逆的是点1
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究一:备选药品:镁片、铝片、0.500 mol·L-1H2SO4、18.4 mol·L-1H2SO4。
甲同学研究的实验报告:
实验步骤 | 现象 | 结论 |
①用砂纸打磨镁片和铝片; ②分别取等体积等浓度的硫酸于两支试管中; ③将镁片和铝片同时投入到试管中。 | 金属的性质越活泼, 反应速率越快 |
(1)甲同学用砂纸打磨镁片和铝片的原因是______________________________;选择H2SO4浓度为________________。
(2) 实验报告中现象为_______________________________________________。
Ⅱ.探究二:实验室经常用Na2S2O3与H2SO4的反应探究化学反应速率的影响因素,利用图1所示装置(夹持装置略去)进行实验,观察到锥形瓶底部有淡黄色浑浊。
(3)请用化学方程式表示出实验原理_________________________________,乙同学在实验过程中对产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据并绘制出图像(如图2)。

0~20s内反应速率υ1=__________mL·s-1,80~100s内反应速率υ2=__________mL·s-1。不考虑实验测量误差,分析速率差异的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.此酸的电离平衡常数约为1×10-7
B.升高温度,溶液的pH增大
C.该溶液的pH=4
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中存在Cl2+H2O![]() H++Cl-+HClO,当加入AgNO3溶液后,溶液颜色变浅
H++Cl-+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.分别用等体积的蒸馏水和0.010mol/L硫酸洗涤BaSO4沉淀,后者损失的BaSO4沉淀少
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图,若烧瓶是干燥的。当烧瓶口向上时,由A口导入气体,可收集下列中的____________(填序号,下同)气体。若烧瓶充满水,可收集下列中的________气体。
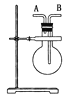
① NO ②NH3 ③SO2 ④ NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放置,由______口导入气体可收集NO气体,其原因是 ____________________________________________。
(3)实验室通常制备氨气的化学方程式 ______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO气体和CO2气体相比较,下列叙述中正确的是
A.物质的量之比为7:11B.原子数之比为22:21
C.体积之比为1:1D.密度之比为11:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com