
【题目】(1)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为__,硫原子和氧原子个数之比为___。
(2)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是__。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__。
(4)已知15.6gNa2X固体中含有0.4molNa+。请计算:
a.X的相对原子质量为__。
b.将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为___mol/L。
(5)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是__;密度最小的是__。(填化学式)
(6)漂白粉是用Cl2与___(填化学式)反应来制取的,漂白粉是___(填“混合物”或“纯净物”),其有效成分为__(填化学式)。
【答案】1:1 2:5 0.25mol/L 4:3 32 0.5 CO2 H2 Ca(OH)2 混合物 Ca(ClO)2
【解析】
(1)将质量比为4:5的SO2和SO3混合,设SO2和SO3的质量分别是4g和5g,则SO2和SO3的物质的量分别是![]() 、
、![]() ,混合气体中SO2和SO3的物质的量之比为1:1,硫原子和氧原子个数之比为(1+1): (1×2+1×3)=2:5。
,混合气体中SO2和SO3的物质的量之比为1:1,硫原子和氧原子个数之比为(1+1): (1×2+1×3)=2:5。
(2)将5mol/L盐酸10mL稀释到200mL,设稀释后溶液的物质的量浓度是cmol/L,根据稀释前后溶质物质的量不变,5mol/L×10mL = cmol/L×200mL,c =0.25mol/L。
(3)设NH3和CH4的物质的量分别是xmol、ymol,使NH3与CH4含相同数目的H原子,则3x=4y,![]() ,NH3和CH4的物质的量之比为4:3。
,NH3和CH4的物质的量之比为4:3。
(4)已知15.6gNa2X固体中含有0.4molNa+,则Na2X的物质的量是0.2mol,Na2X的摩尔质量是![]() 78g/mol;
78g/mol;
a. X的相对原子质量为78-23×2=32。
b. 39gNa2X的物质的量是![]() 0.5mol,含有1molNa+,将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为
0.5mol,含有1molNa+,将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为![]() =0.5mol/L。
=0.5mol/L。
(5)质量都是10g的HCl、NH3、CO2、H2四种气体,物质的量分别是![]() 、
、![]() 、
、![]() 、
、![]() ,相同条件下,气体物质的量与体积成正比,在标准状况下,体积最小的是CO2;相同条件下,密度与摩尔质量成正比,密度最小的是H2。
,相同条件下,气体物质的量与体积成正比,在标准状况下,体积最小的是CO2;相同条件下,密度与摩尔质量成正比,密度最小的是H2。
(6)漂白粉是用Cl2与Ca(OH)2反应来制取的,Cl2与Ca(OH)2反应生成氯化钙、次氯酸钙、水,漂白粉是氯化钙、次氯酸钙的混合物,其有效成分为Ca(ClO)2。


科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》杂志曾报道我国科学家设计的CO2熔盐捕获与转化装置,其示意图如图所示,下列有关说法正确的是
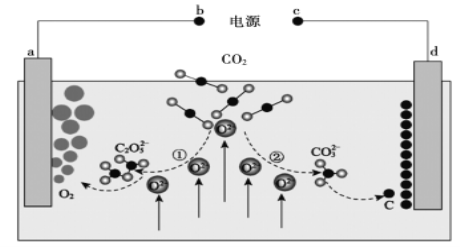
A. b为负极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极电极反应式为![]()
D. 转移1mol电子可捕获CO2气体22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)向A、B溶液中分别滴入几滴KSCN溶液, A溶液颜色:________B溶液颜色_______。
(2)写出上述过程中有关反应的离子方程式:A→B___________________。若有2mol的A参与该反应,则转移______mol电子。A作_____剂
(3)B→C(暴露在空气中)可看到的现象是__________________________________。
(4)将A的饱和溶液制成胶体的操作______________________;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_____________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有___,CH3OH的熔、沸点比CH4高,其主要原因是__________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100nL,Va、Vb与混合液的p的关系如图所示。下列说法正确的是

A. Ka(HA)=Kb(BOH)=1×10-6B. b点时,c(A-)=c(B+)=c(H+)=c(OH-)
C. c点时,c(A-)>c(B+)D. a→c过程中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入28克N2,右边充入8克CO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同)。下列说法正确的是

A.右边CO和CO2的分子数之比为1∶3
B.右边CO的质量为2.75克
C.若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,保持温度不变,则前后两次充入密闭容器内的气体总压强之比为25∶24
D.右侧气体密度是相同条件下氢气密度的32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是( )
A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
C.将饱和氯化铁溶液滴入沸水中得到红褐色分散系:FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
D.向CuO粉末中加入碳粉加热得到红色固体:2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
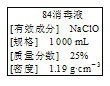
(1)该“84消毒液”的物质的量浓度约为___ mol·L-1。(取整数)
(2)某同学取100 mL 该“84消毒液”,稀释100倍后用于消毒,稀释后的溶液中c(Na+)=_____ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是____(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
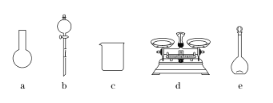
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com