
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/x Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/x Sx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3可以和浓HNO3反应,当生成0.6mol的H3AsO4时,反应中转移电子的数目为3NA,则As2S3和浓HNO3反应的方程式是
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS、S2的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
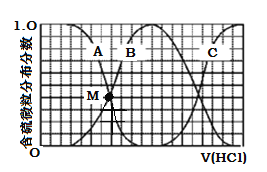
①曲线B表示 的分布分数。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
A.c(Na+)= c(HS)+2c(S2)
B.3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH)
C.3c(Na+)=[c(H2S)+c(HS)+c(S2)]
③NaHS溶液呈碱性,当滴加盐酸至M点(A、B曲线的交叉点)时,溶液中各离子浓度由大到小的顺序为
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
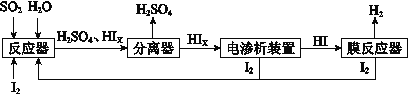
①写出反应器中发生反应的化学方程式是 。
②电渗析装置如下图所示
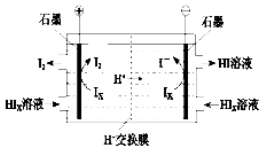
写出阳极的电极反应式 。
该装置中发生的总反应的化学方程式是 。
【答案】(1)xCOS(g)=xCO(g)+Sx(s) △H=0.5x(b a)kJ/mol
(或 2COS(g)=2CO(g)+2/xSx(s) △H=(b a)kJ/mol )
(2)As2S3+10H++ 10NO3=2H3AsO4+3S+10NO2↑+ 2H2O
(3)①HS(或NaHS) ② B ③c(Na+)> c(HS)=c(S2) >c(OH)>c(H+)
(4)①SO2 + xI2 + 2H2O = H2SO4 + 2HIX ②2Ix -2e = xI2 2HIx=(x-1) I2 + 2HI
【解析】
试题分析:(1)①SO2(g)+2CO(g)=2CO2(g)+1/x Sx(s)△H=akJ/mol,②2COS(g)+SO2(g)=2CO2(g)+3/x Sx(s) △H=bkJ/mol,根据盖斯定律,0.5x×(②-①)可得:xCOS(g)=xCO(g)+Sx(s) △H=0.5x(b a)kJ/mol。
(2)已知As2S3可以和浓HNO3反应,当生成0.6mol的H3AsO4时,反应中转移电子的数目为3NA,则生成1molH3AsO4时转移5mol电子,浓硝酸生成NO2,化合价由+5价降低到+4价,转移5mol电子时,生成5molNO2,然后根据得失电子守恒和原子守恒配平,硝酸反应失去5mol电子,As元素的化合价由+5价则As2S3和浓HNO3反应的方程式是As2S3和浓HNO3反应的方程式是As2S3+10H++ 10NO3=2H3AsO4+3S+10NO2↑+ 2H2O。
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度在减小,A为Na2S,B先增加后减少为NaHS,C浓度一直在增加为H2S。
②向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],A、C错误;溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),再根据物料守恒:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],可得3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH),B项正确;答案选B。
③A表示Na2S,B为NaHS,当滴加盐酸至M点时,c(HS)=c(S2),发生的反应为NaOH+HCl=NaCl+H2O,Na2S+HCl=NaCl+NaHS,所以c(Na+)浓度最大,Na2S是强碱弱酸盐,溶液显碱性,NaHS的水解程度大于其电离程度,NaHS溶液显碱性,则该溶液呈碱性,c(OH-)>c(H+),所以溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS)=c(S2)>c(OH)>c(H+)。
(4)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2 + xI2 +2H2O = H2SO4 + 2HIX ;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix-2e = xI2,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx=(x-1) I2 + 2HI。


科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
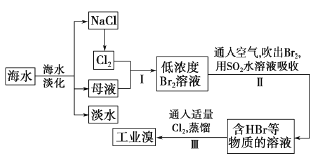
(1)请列举海水淡化的两种方法:________、_________。
(2)步骤I中己获得Br2,步骤II中又将Br2还原为Br-。其目的是_____。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95% 。有关反应的离子方程式为_________。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59 ℃.微溶于水,有毒并有强腐蚀性。他们参观生产过程后.画了如下装置简图:
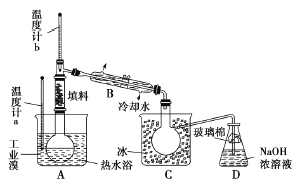
请你参与分析讨论:
①图中仪器B的名称是_______。
② 整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是_______。
③ 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?_______。
④ C中液体颜色为_______。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学元素家族又添新成员,113号元素Uut和115号元素Uup。已知113号元素的一种核素为![]() Uut,下列说法中正确的是
Uut,下列说法中正确的是
A. 113号元素的相对原子质量为278
B. 115号元素可显+5价
C. ![]() Uut的中子数与电子数之差为165
Uut的中子数与电子数之差为165
D. 两种元素均位于周期表第八周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是
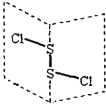
A.S2Cl2的结构式为 Cl—S—S—Cl
B. S2Cl2与水反应时只有S—Cl断裂
C.S2Br2含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
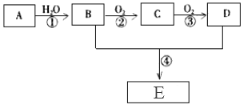
(1)写出A的结构简式 。
(2)B、D分子中所含官能团的名称分别是 、 。
(3)物质B可以直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
反应②的化学方程式: ;反应类型: 。
反应④的化学方程式: ;反应类型: 。
(5)B可由含淀粉的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式。
____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY,此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) ![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
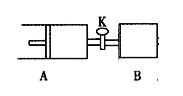
A.反应速率:v(B)>v(A)
B.B容器中X的转化率为80%
C.平衡时的压强:2p(A)=p(B)
D.平衡时Y的体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、今有A.醋酸,B.盐酸,C.硫酸三种酸,请用三种酸的序号和“>”“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)物质的量浓度均为0.1 mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1 mol/L的三种酸溶液,用0.1 mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
II、用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)甲方案中,说明HB是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
(2)请你评价乙方案中难以实现之处和不妥之处: 。
III、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。
已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO
A.①③④
B.③⑦
C.③⑤
D.⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com