
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素单质的电子式为________;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质的晶体类型属于________________;基态D原子共有__________种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是__________,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是_______(填化学式),此配离子中的两种配体的不同之处为_____________(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型
(3)1 mol BC-中含有的π键数目为________;写出与BC-互为等电子体的分子和离子各一种________、_________(填化学式)。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是___________________________。
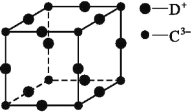
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,则C3-的配位数为________,晶体的密度为_____ g·cm-3。
【答案】H:H 原子晶体或混合晶体 29 sp3 [Cu(H2O)2(NH3)2]2+ ② 2NA CO或N2 C![]() 硫酸铜的晶格能比硝酸铜的晶格能高 6
硫酸铜的晶格能比硝酸铜的晶格能高 6 ![]()
【解析】
A、B、C、D是原子序数依次递增的前四周期元素,B元素原子的价电子结构为nsnnpn,则B为C,A元素的正化合价与负化合价的代数和为零,则A为H,C元素基态原子s能级的电子总数比p能级的电子总数多1,则C为N,D元素原子的M能层全满,最外层只有一个电子,则D为Cu。
(1)A元素单质为氢气,其电子式为H:H;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质可能为金刚石或石墨,其晶体类型属于原子晶体或混合晶体;基态原子有多少个电子就有多少种不同运动状态的电子,因此基态D原子共有29种不同运动状态的电子;故答案为:H:H;原子晶体或混合晶体;29。
(2)A与C形成的最简单分子为氨气,中心原子价层电子对数![]() ,杂化方式是sp3,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是[Cu(H2O)2(NH3)2]2+,两种配体中心原子的价层电子对数分别为
,杂化方式是sp3,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是[Cu(H2O)2(NH3)2]2+,两种配体中心原子的价层电子对数分别为![]() 、
、![]() ;中心原子的孤电子对的对数,氨气有1对,水有2对;中心原子的化学键类型都为极性共价键;VSEPR模型都为四面体形;因此配离子中的两种配体的不同之处为②;故答案为:sp3;[Cu(H2O)2(NH3)2]2+;②。
;中心原子的孤电子对的对数,氨气有1对,水有2对;中心原子的化学键类型都为极性共价键;VSEPR模型都为四面体形;因此配离子中的两种配体的不同之处为②;故答案为:sp3;[Cu(H2O)2(NH3)2]2+;②。
(3)1 mol BC-即CN-,与氮气互为等电子体,因此1 mol CN-含有的π键数目为2NA;根据C-=N,O=N-,与BC-互为等电子体的分子和离子各一种CO或N2、![]() ;故答案为:2NA;CO或N2、
;故答案为:2NA;CO或N2、![]() 。
。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,主要是硫酸根比硝酸根带的电荷多,硫酸铜的晶格能比硝酸铜的晶格能高;故答案为:硫酸铜的晶格能比硝酸铜的晶格能高。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,根据结构分析,以顶点的N3分析,N3的配位数为6,晶胞中N3个数为1,Cu+个数为3,化学式为Cu3N,晶体的密度为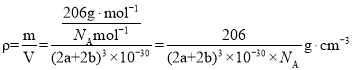 ;故答案为:6;
;故答案为:6;![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,HCOOH和CH3COOH的电离常数分别1.80×104和1.75×105。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
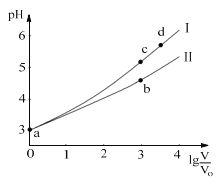
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中![]() 不变(HA、A-分别代表相应的酸和酸根离子)
不变(HA、A-分别代表相应的酸和酸根离子)
D.若两溶液无限稀释,则它们的c(H+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.c(![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(![]() )+c(NH3·H2O)
)+c(NH3·H2O)
C.溶液X:10 mL 0.1 mol·L-1 NaCl;溶液Y:10 mL 0.1 mol·L-1 CH3COONa,则:X中离子总浓度>Y中离子总浓度
D.少量的氯气通入过量冷的0.1 mol·L-1NaOH溶液中:c(Na+)=c(HClO)+c(ClO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226kJ/mol
O2(g) ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
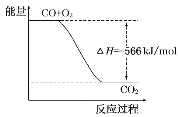
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH=-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是( )
A.钠与水反应的离子方程式:Na+H2O=Na++OH-+H2↑
B.铁与水蒸气反应的化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
C.镁、铝与沸水不可能反应
D.钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知由金属钠制得氧化钠,可用多种方法:a.4Na+O2===2Na2O,b.4Na+CO2===2Na2O+C,c.2NaNO2+6Na===4Na2O+N2↑。
①在上述三种方法中,最好的方法是________(填序号),原因是________________。
②上述反应c中NaNO2作________剂,当有1 mol NaNO2反应时,电子转移的数目是________________________________________________________________________。
(2)现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):
①装置Ⅳ中盛放的药品是________,其作用是____________________________。
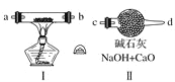
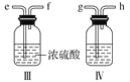
②若规定气体的气流方向从左到右,则组合实验装置时各仪器接口的标号字母(a、b……)顺序:空气进入________,________接________,________接________,________接________。
③装置Ⅱ的作用____________________________________________________。
④操作中通空气和加热的顺序为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。关于常温下pH=5的NaH2PO4溶液,下列说法正确的是
A.溶液中含有的H+的数目为10-5NA
B.c(H+)+c(H3PO4)=c(OH-)+c(HPO![]() )
)
C.NaH2PO4溶液呈酸性是因为H2PO![]() 发生了水解反应
发生了水解反应
D.加入pH=5的稀硫酸,溶液的酸性不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌、铁、铜及其化合物在生活、生产中有着广泛应用。回答下列问题:
(1)基态Fe3+的核外电子排布式为____________。在第四周期过渡元素中,基态原子未成对电子数最多的元素为____________(用元素符号表示)。
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的非金属元素电负性由大到小的顺序是____________(用元素符号表示);甘氨酸分子中N原子的杂化轨道类型为____________;从结构角度解释甘氨酸易溶于水的原因:________________。
(3)铜元素的第一电离能、第二电离能分别为746 kJ·mol-1、1958 kJ·mol-1;锌元素的第一电离能、第二电离能分别为906 kJ·mol-1、1733 kJ·mol-1,铜的第二电离能大于锌的第二电离能,其主要原因是___________________________________________________。
(4)磷酸铁(FePO4)可用于制造磷酸铁锂电池材料,PO![]() 的空间构型为______________。
的空间构型为______________。
(5)某种化合物由Fe、Cu、S三种元素组成,其晶胞结构如图所示,则化学式为__________,该晶胞上、下底面均为正方形,侧面与底面垂直,若该晶体的密度ρ g·cm-3,设NA为阿伏加德罗常数的值,结合图中的数据计算底面棱长a=____________(只要求列出计算式,用含b的代数式表示)pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷C5H12催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2 |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com