
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H=" -1275.6" kJ·mol-1
② H2O(l) H2O(g) △H=" +" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g) 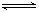 CH3OH(g) CH3OH(g) |
| 方法二 | CO2(g) +3H2(g) 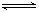 CH3OH(g) +H2O(g) CH3OH(g) +H2O(g) |
(1)CH3OH(l)十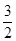 O2(g)
O2(g) CO2(g)+2H2O(l) △H= -725.8kJ/mol
(2)①< 加入催化剂、AC; ②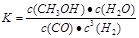 大于 1.56
大于 1.56
(3) 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
解析试题分析:(1)甲醇的燃烧热是1mold的甲醇完全燃烧产生液态水和气态二氧化碳时所释放飞热量。根据题意可得燃烧热数值为1275.6 kJ/mol÷2+2×44.0 kJ.mol=725.8kJ/mol,所以燃烧热的化学方程式为CH3OH(l)十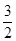 O2(g)
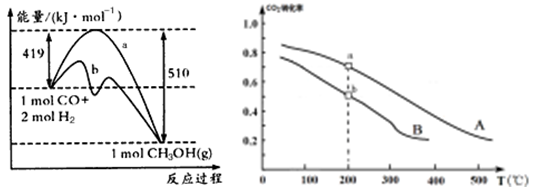
O2(g) CO2(g)+2H2O(l) △H= -725.8kJ/mol;(2)①在方法一中由于消耗3mol的气体产生了1mol的气体,所以体系的混乱程度减小,因此该反应的△S<0;图中曲线a的活化能大,而曲线b的活化能小,所以曲线a到曲线b的措施是加入催化剂;A.因为反应前后气体的体积不等,若反应未达到平衡,则气体的物质的量就要发生变化,体系的平均摩尔质量也要改变,若体系的平均摩尔质量不变,则气体的物质的量不变,反应达到平衡。正确。B. 因为在方程式中CO与CH3OH的系数相同,所以任何时刻都存在V(CO)= V(CH3OH),因此该条件不能作为判断平衡的标志。错误。C. 若反应未达到平衡,则H2的转化率就没有达到了最大限度。现在H2的转化率达到了最大限度,说明反应达到了平衡状态。正确。D.对于一个确定的反应,其△H不会因为反应进行的程度的大小而发生改变。因此该条件不能作为判断化学反应平衡状态的标志。错误。故选项为AC。②反应CO2(g) +3H2(g)  CH3OH(g) +H2O(g)在a点时的平衡常数是
CH3OH(g) +H2O(g)在a点时的平衡常数是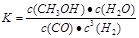 由于a,b两点对应的温度相同,CO2的转化率a>b,说明压强a>b,在其它条件不变时增大压强,物质的浓度增大,化学反应速率加快,所以Va>Vb表示;在方法一中由于反应物的原子全部转化为生成物,所以其原子利用率是100%;而方法二中原子利用率是32÷(32+18)×100%=64%.因此方法一的原子利用率是方法二的原子利用率的100% ÷64% =1.56。(3)根据题意可得Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
由于a,b两点对应的温度相同,CO2的转化率a>b,说明压强a>b,在其它条件不变时增大压强,物质的浓度增大,化学反应速率加快,所以Va>Vb表示;在方法一中由于反应物的原子全部转化为生成物,所以其原子利用率是100%;而方法二中原子利用率是32÷(32+18)×100%=64%.因此方法一的原子利用率是方法二的原子利用率的100% ÷64% =1.56。(3)根据题意可得Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:考查热化学方程式和离子方程式的书写、体系的混乱程度和化学平衡状态的判断、平衡常数的表达式的书写、原子利用率的计算的知识。


科目:高中化学 来源: 题型:填空题
降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是 (填:a或b);
0—8min内该反应的平均速率v(CO2)= mol/(L·min)。
(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)  CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知1molCaCO3分解需要吸收178kJ 热量,1mol焦炭完全燃烧放出393.5kJ ,试回答下列问题
(1)写出碳酸钙分解的热化学反应方程式
(2)试计算如果0.5t CaCO3煅烧成CaO(s),在理论上要用焦炭多少千克。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分) 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。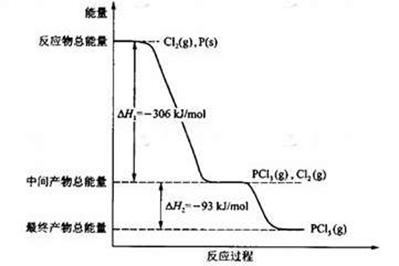
根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率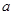 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为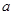 2,
2,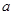 2
2 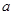 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示: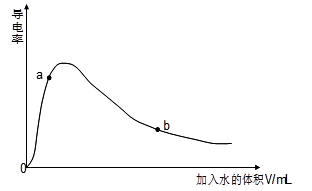
①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1="-57.3" kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种可再生的优质燃料,用途广泛,研究其作用具有广阔前景。
(1)已知在常温常压下,测得反应的反应热如下:
① 2CH3OH(l)+ 3O2(g)  2CO2(g) +4H2O(g) ?H1= -1275.6 kJ/mol
2CO2(g) +4H2O(g) ?H1= -1275.6 kJ/mol
② 2CO(g) +O2(g)  2CO2(g) ?H2=-566.0 kJ/mol
2CO2(g) ?H2=-566.0 kJ/mol
CH3OH不完全燃烧生成CO和气态水的热化学方程式是 。
(2)工业上生产甲醇的反应如下:CO2(g) + 3H2(g)  CH3OH(g)+ H2O(g) ?H = -49 kJ/mol
CH3OH(g)+ H2O(g) ?H = -49 kJ/mol
在某温度下,容积均为1 L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容。容器B中经10 s后达到平衡。达到平衡时的有关数据如下表:
| 容器 | A | B |
| 反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
| 反应能量变化 | 放出αkJ热量 | 吸收19.6 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com