
| A、2SO2+O2?2SO3的平衡体系中,加入由18O构成的氧气,则SO2中的18O的含量会增加 | ||||||
B、 I2(g)+H2(g)?2HI(g)加压后颜色加深 I2(g)+H2(g)?2HI(g)加压后颜色加深 | ||||||
C、
| ||||||
D、
|


科目:高中化学 来源: 题型:
| A、用过量的碱液除去CO2中混有的少量HCl气体 |
| B、用饱和食盐水除去氯气中混有的HCl气体 |
| C、用升华的方法除去食盐中少量的I2 |
| D、用过量的氯化钡溶液除去亚硫酸钠溶液中的少量SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成了一种强酸弱碱盐 |
| B、弱酸溶液与强碱溶液反应 |
| C、强酸溶液与强碱溶液反应 |
| D、一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
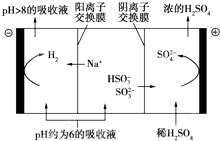 最近雾霾天气又开始肆虐我国大部分地区.其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.
最近雾霾天气又开始肆虐我国大部分地区.其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.| n(SO32-):n(HSO3- ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、离子结构示意图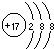 只能表示 只能表示
| ||
B、水的球棍模型: | ||
| C、碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- | ||
D、作为相对原子质量标准的碳原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com