
【题目】下列能用勒沙特列原理解释的是
A. Fe(SCN)3溶液中加入固体KSCN后颜色变深
B. 棕红色Br2蒸气加压后颜色变深
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. H2、I2、HI平衡混和气加压后颜色变深
科目:高中化学 来源: 题型:
【题目】对于化学反应:N2(g)+O2(g)![]() 2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
A.缩小体积使压强增大______________________________________________________。
B.体积不变充入N2使压强增大________________________________________________。
C.体积不变充入氩气使压强增大_______________________________________________。
D.压强不变充入氩气使体积增大_______________________________________________。
E.增大体积使压强减小_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为__。
(2)x=__。
(3)下列各项可作为该反应达到平衡状态的标志是__(填字母)。
A.气体密度不再变化
B.压强不再变化
C.A的消耗速率与B的消耗速率之比为2:1
D.气体平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)![]() 2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
A.v 正(B)=2v 逆(C)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中气体 B 的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):

(1)操作1的名称是___________。
(2)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应离子方方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及____________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(2)已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
i.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+113.4kJ/mol (1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=__________。
(2)在反应i中,每放出38.0kJ热量,有______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2mol CO2和8molH2,发生反应CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。

(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=________。
②300℃时,反应的平衡常数K=________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_______(填字母)。
A.等于0.8mol/L B.等于1.6mol/L
C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时.该反应的平衡常数K=61.8L2·mol-2。则△H4___0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为____________。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CH4与Cl2的反应(如图所示)叙述不正确的是
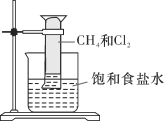
A. 该反应的生成物有四种
B. 该反应属于取代反应
C. 该反应的条件是光照
D. 该反应的现象是量筒内气体颜色变浅,器壁上有油状液滴,量筒内液面上升并产生白雾,溶液中有晶体析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com