
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:2NO(g) + O2(g) ![]() 2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g)
2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g) ![]() 2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为__________________________。
② 随温度升高,该反应化学平衡常数变化趋势是____________。(填“增大”或“减小”或“不变”)
(2)提高2SO2 + O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该温度下反应的平衡常数K=_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,升高体系温度
(3)汽车尾气是氮氧化物的一个主要来源。汽缸中生成NO的反应为:N2 (g) + O2 (g) ![]() 2NO(g) △H>0
2NO(g) △H>0
汽车启动后,汽缸温度越高,单位时间内NO的排放量越大,其原因是_______________。
(4)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式____________________。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
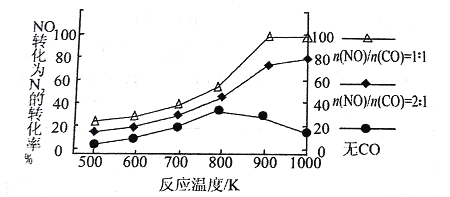
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为________、________;该反应的H________0(填“>”、“<”或“=”)。
【答案】NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1 减小 2L/mol bc 升高温度,反应速率加快,平衡向正向移动,则NO的排放量单位时间内增多 2NO+2CO![]() N2+2CO2 900K n(NO)/n(CO)=1∶1 >
N2+2CO2 900K n(NO)/n(CO)=1∶1 >
【解析】
根据盖斯定律计算反应热;根据化学平衡常数的计算公式及其与温度的关系、外因对化学平衡的影响进行相关的判断;认真分析图象中信息。
(1)给已知热化学方程式编号:
(a)2NO(g) + O2(g) ![]() 2NO2(g) △H= -113.0 kJ·mol-1,
2NO2(g) △H= -113.0 kJ·mol-1,
(b)2SO2(g)+ O2 (g) ![]() 2SO3(g) △H=-196.6 kJ·mol-1 。
2SO3(g) △H=-196.6 kJ·mol-1 。
①消去无关物质O2,将(b-a)/2得NO2和SO2反应的热化学方程式:
NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1 。
②温度升高,平衡左移,该反应化学平衡常数减小。
(2)①温度T、1L:2SO2 + O2 ![]() 2SO3
2SO3
起始/mol 2.0 1.0 0
转化/mol 2.0×50% 0.5 1.0
平衡/mol 1.0 0.5 1.0
平衡时SO2、O2、SO3浓度分别是1.0mol·L-1、0.5mol·L-1、1.0mol·L-1, T温度时反应的平衡常数K=2L/mol。
②a.温度和容器体积不变时充入He,化学平衡不移动,SO2的转化率不变;b.温度和容器体积不变时充入1.0 mol O2,平衡右移,SO2的转化率增大;c.在其他条件不变时减少容器的体积,即增大压强,平衡右移,SO2的转化率增大;d.在其他条件不变时升高体系温度,平衡左移,SO2的转化率减小。选bc。
(3)对于反应:N2 (g) + O2 (g) ![]() 2NO(g) △H>0,升高温度,反应速率加快,平衡向正向移动,则单位时间内NO的排放量增多。
2NO(g) △H>0,升高温度,反应速率加快,平衡向正向移动,则单位时间内NO的排放量增多。
(4)①CO还原NO生成N2的化学方程式2NO+2CO![]() N2+2CO2。
N2+2CO2。
②从图中看,900K、n(NO)/n(CO)=1∶1时,NO转化为N2的转化率最大。当n(NO)/n(CO)一定时,温度升高,NO转化率增大。故正反应吸热、H>0。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:

已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为________。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为________________________。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是___________。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响

(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为___________。

(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案: ____________________________(实验中须使用的试剂有:30%双氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了延长水果的保鲜期,下列的水果存放方法最合适的是
A.放入敞口的容器中 B.放入浸泡过高锰酸钾溶液硅土的密封容器中
C.放入密封的容器中 D.放入充有少量乙烯的密封容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
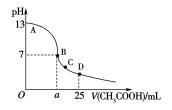
A. 在A、B间任一点,溶液中一定都c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. 在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C. 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. 在D点:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,如图1,请据图回答:

(1)小麦种子细胞中,物质A是______________,物质E是______________。艾滋病毒中的H彻底水解后可以得到________种产物。
(2)相同质量的E和F彻底氧化分解,耗氧量较多的是___________。
(3)若a个C物质组成b条链,组成某种物质G,该物质G至少含有氧原子的个数是________。若G是一条含121个氨基酸构成的链状结构,其中含5个甘氨酸(其R基为-H),分别位于26、71、72、99、121位(见下图)。
![]()
肽酶E1专门水解甘氨酸羧基端的肽键,肽酶E2专门水解甘氨酸氨基端的肽键。肽酶E1完全作用后产生的多肽中,至少有________个羧基。
(4)图二表示小麦开花数天后测定的种子中主要物质的变化图,请据图回答问题:
①小麦成熟种子中主要的有机营养物质是________,检测可溶性还原糖的试剂是_________,可溶性还原糖的多少可以通过________________来判断。
②种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为了验证磷酸化酶是否为蛋白质,实验过程中实验组试管中加入2ml________,对照组试管中加入_______,然后在两支试管中分别加入等量双缩脲试剂,如果实验组试管中同样出现____________现象,则证明磷酸化酶是蛋白质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.6 g H2O的物质的量是____,含有水分子的数目是_____,含有氢原子的物质的量是_____。
(2)1.5molCO2和______g CH4在标准状况下占有相同的体积,其体积为________。
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量为________。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为______mol;一个X原子的质量为_______g;该气体在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
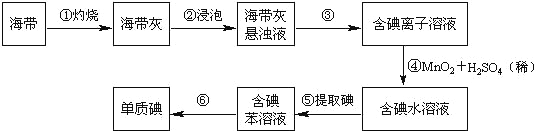
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质的比较中,正确的是
A.非金属性:Br>ClB.稳定性:H2S>H2O
C.酸性:H2CO3>HNO3D.碱性:Ca(OH)2>Mg(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com