
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。
(2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ;
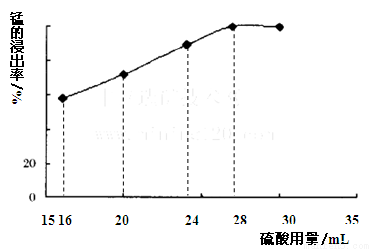
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应)
(1)4OH- -4e- =O2 + 2H2O 或2H2O – 4e-=O2↑ + 4H+
(2)(C6H10O5)n + nH2O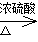 nC6H12O6; C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。
nC6H12O6; C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。
(3)H2S或SO2(写出其中一个即得分) (4)(NH4)2SO4 (5)28,CaCO3 (6)17.92
【解析】
试题分析:(1)电解池中阳极失去电子,发生氧化反应,则工业上电解硫酸锰的水溶液生产金属锰时阳极是溶液中的氢氧根离子放电产生氧气,其电极反应式为为4OH- -4e- =O2 + 2H2O。
(2)木屑中含有纤维素,在硫酸的作用下水解生成葡萄糖,则水解反应的化学方程式为(C6H10O5)n + nH2O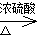 nC6H12O6;根据反应式可知葡萄糖中碳元素的化合价从0价升高到+4价,失去4个电子,而锰元素的化合价从+4价降低到+2价,得到2个电子,因此还原剂与氧化剂的物质的量之比是1:12,所以配平后的化学方程式为 C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。
nC6H12O6;根据反应式可知葡萄糖中碳元素的化合价从0价升高到+4价,失去4个电子,而锰元素的化合价从+4价降低到+2价,得到2个电子,因此还原剂与氧化剂的物质的量之比是1:12,所以配平后的化学方程式为 C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。
(3)若取消除酸操作步骤,则在后续操作中需要加入硫化铵,因此氢离子与硫离子结合生成H2S气体而污染环境。
(4)根据流程图可知溶液中的硫酸根与溶液中的铵根结合生成(NH4)2SO4,硫酸铵可用于化肥。
(5)根据图像可知,当硫酸用量达到28ml时,锰的浸出率几乎不再增加,因此硫酸的最合适用量为28mL.由于过量的硫酸需要通过碳酸钙除去,因此若再增加硫酸的用量,将会导致CaCO3的消耗量增大。
(6)二氧化锰的质量=174g×0.5=87g,物质的量是1mol。氯化氢的物质的量=320g×36.5%÷36.5g/mol=3.2mol。根据反应式MnO2+4HCl(浓)△MnCl2+2H2O+Cl2↑可知二氧化锰过量,因此产生的氯气物质的量是3.2mol÷4=0.8mol,但由于随着反应的进行,盐酸的浓度逐渐降低,所以实际产生的盐酸的物质的量小于0.8mol,即小于0.8mol×22.4L/mol=17.92L。
考点:考查硫酸锰工艺流程的有关判断与计算


科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
在下列有关说法中正确的是
①相同质量的CH4、C2H4、C2H2完全燃烧时耗O2量的关系为CH4 > C2H4 >C2H2
②对于任意比混合的乙烯、丙烯和环丁烷混合气体在足量氧气中燃烧,只要混合气体的质量不变,完全燃烧后产生的CO2和H2O的量也不改变
③对于任意比混合的C2H4、C2H6、C2H2混合气体,只要混合气体物质的量不变,完全燃烧后产生的CO2物质的量也不改变
④某有机物在足量氧气中燃烧后产生CO2与H2O的物质的量之比为2:3,则该有机物的类型肯定为烷烃
A.①②③B.①②③④C. ②③D.以上组合均不正确
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高一下学期期末考试化学试卷(解析版) 题型:选择题
W、X、Y、Z是短周期元素,其部分性质如表,下列说法正确的是
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的2/3 |
Z | 第三周期原子半径最小的金属 |
A.气态氢化物的热稳定性:X<W
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.Y的氧化物中含有非极性共价键
查看答案和解析>>
科目:高中化学 来源:2013-2014广东佛山市顺德区高三5月教学质量检测理综化学试卷(解析版) 题型:填空题
(16分)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。

查阅资料得下表相关数据:
表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的 (选填试剂编号)。
(2)步骤②发生反应的离子方程式为 ;步骤⑤中发生反应的化学方程为 。
(3)步骤③控制pH=9.8的目的是 。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、 和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东佛山市顺德区高三5月教学质量检测理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.青铜中含有的主要合金元素是锡和铅
B.装运浓硫酸的铝罐车,在卸货后不能用水冲洗铝罐的内部
C.半导体工业所说的“从沙滩到用户”是指将二氧化硅制成晶体硅
D.氮的固定只有在高温、高压、催化剂的条件下才能实现
查看答案和解析>>
科目:高中化学 来源:2013-2014广东中山一中、宝安中学等高三七校5月联考化学试卷(解析版) 题型:选择题
100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:
A.pH=11的氨水中:c(OH-)=3.0mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-)
C.pH=2的稀盐酸中,c(H+)=c(Cl-)
D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省汾阳市高一期末统考化学试卷(解析版) 题型:填空题
(11分)乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸B.溴的四氯化碳溶液 C.水D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3B.CH3CHCl2 C.CH3CH2OHD.CH3CH2Br
(4)已知 2CH3CHO+O2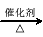 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。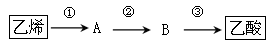
反应②的化学方程式为____________________________________。工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_______________,反应类型是______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省汾阳市高一期末统考化学试卷(解析版) 题型:选择题
在元素周期表中金属与非金属的分界处,可以找到( )
A.合金B.半导体材料C.催化剂D.农药
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省第二学期期末考试高一化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是( )
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 B.汽油、乙烯均为石油分馏产品
C.可以用分液的方法分离硝基苯和苯 D.有机化合物都能燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com