
【题目】“碳呼吸”电池原理如图所示,(电解质溶液为含C2O![]() 的盐溶液,电池总反应为2A1+ 6CO2=Al2(C2O4)3,下列有关说法正确的是
的盐溶液,电池总反应为2A1+ 6CO2=Al2(C2O4)3,下列有关说法正确的是

A.Al作负极B.C2O![]() 由负极迁移至正极
由负极迁移至正极
C.该装置将电能转变为化学能D.每生成1 mol Al2(C2O4)3,需要消耗134.4L的CO2
【答案】A
【解析】
根据电池总反应为2A1+ 6CO2=Al2(C2O4)3分析可知,Al的化合价升高,被氧化,故Al是负极,CO2在反应中C的化合价降低,被还原,故通CO2的一极为正极,据此进行解题。
A.根据分析可知Al作负极,A正确;
B.原电池中阳离子移向正极,阴离子移向负极,故C2O![]() 由正极迁移至负极,B错误;
由正极迁移至负极,B错误;
C.原电池装置是实现将化学能转变为电能,C错误;
D.通过反应2A1+ 6CO2=Al2(C2O4)3可知每生成1 mol Al2(C2O4)3,需要消耗6molCO2,这些二氧化碳在标准状况下的体积为:6mol×22.4L/mol=134.4L,但是题干未告知标准状况下,故无法求算CO2的体积,D错误;
故答案为:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是__(用离子方程式表示)。向该溶液中滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为__mol·L-1。(NH3·H2O的电离平衡常数为Kb=2×10-5)
(2)如图1是0.1mol/L电解质溶液的pH随温度变化的图像。
①其中符合0.1mol/LNH4Al(SO4)2溶液的pH随温度变化的曲线是__(填写字母),导致pH随温度变化的原因是__;
②20℃时,0.1mol/L的NH4Al(SO4)2溶液中2c(SO42-)-c(NH4+)-3c(Al3+)=___(填数值)。
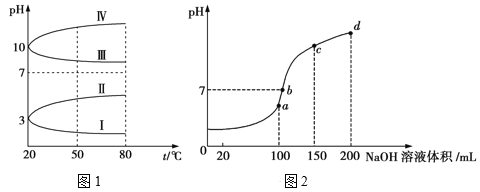
(3)室温时,向100mL0.1mol/L的NH4HSO4溶液中滴加0.1mol/LNaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国于2007年11月成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量进行探测等,月球的矿产资源极为丰富,仅月面表层![]() 厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石
厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石![]() 、斜长石
、斜长石![]() 和橄榄石
和橄榄石![]() 等,下列说法或分析不正确的是( )
等,下列说法或分析不正确的是( )
A.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
B.辉石、斜长石及橄榄石均属于硅酸盐矿
C.橄榄石中铁为![]() 价
价
D.斜长石的氧化物形式可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
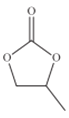
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。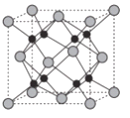
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取某固体样品进行如下实验:
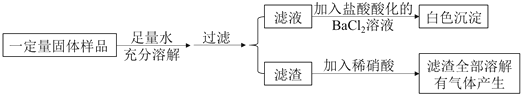
根据实验现象,该固体样品的成分可能是
A.Na2CO3、AgNO3、KNO3B.K2SO4、Ba(OH)2、Na2CO3
C.K2CO3、NaCl、Ba(NO3)2D.K2SO4、MgCl2、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子的杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A |
|
| 直线形 | 直线形 |
B |
|
| 平面三角形 | 三角锥形 |
C |
|
| 四面体形 | 平面三角形 |
D |
|
| 四面体形 | 正四面体形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
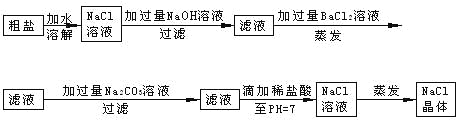
试简要说明:
(1)加入过量BaCl2的溶液的原因___________________。
(2)加入过量Na2CO3的溶液的原因_________________________。
(3)滴加稀盐酸直至pH=7的目的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分, 回答下列问题。
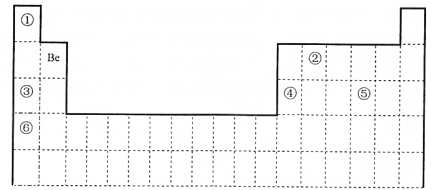
(1)我国科学家采用“铝铍测年法”测量“北京人”年龄。10Be 和9Be______________
a.是同一种核素 b.具有相同的中子数 c.互为同素异形体 d.互为同位素
(2)元素①和②可形成多种化合物。下列模型表示的分子中,不可能由①和②形成的是_______(填序号)。
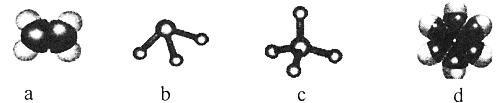
(3)元素①~⑥中,金属性最强的是___(填元素符号)。②的单质和⑤的最高价氧化物对应水化物的浓溶液反应的化学方程式为______________。
(4)碘(53I) 是人体必需的微量元素之一。
①碘(53I) 在周期表中的位置是______
②CI-、Br-、I-的还原性由大到小的顺序为_______。
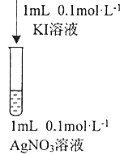
③资料显示: Ag+和I-会发生氧化还原反应生成两种单质,反应的离子方程式为_______。某同学用图实验验证上述反应,观察到两溶液混合后立即出现黄色浑浊,再加入淀粉溶液,不变蓝。分析产生上述现象的可能原因:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com