
| A. | 用酸性高锰酸钾溶液检验丙烯醇(CH2=CHCH2OH)含不饱和键 | |
| B. | 用溴水检验溴乙烷在氢氧化钠乙醇溶液中发生消去反应的产物有乙烯 | |
| C. | 用碘水溶液检验淀粉在稀硫酸中是否发生了水解反应 | |
| D. | 用银氨溶液检验甲酸甲脂和丙醛 |
分析 A.-OH、碳碳双键均能被高锰酸钾氧化;
B.溴乙烷在氢氧化钠乙醇溶液中发生消去反应,生成乙烯,且乙烯与溴水发生加成反应;
C.淀粉遇碘变量,部分水解时不能检验;
D.酸甲脂和丙醛均含-CHO.
解答 解:A.-OH、碳碳双键均能被高锰酸钾氧化,则利用高锰酸钾不能检验碳碳双键,故A错误;
B.溴乙烷在氢氧化钠乙醇溶液中发生消去反应,生成乙烯,且乙烯与溴水发生加成反应,则用溴水可检验消去反应的产物有乙烯,故B正确;
C.淀粉遇碘变量,部分水解时不能检验,则用碘水可检验淀粉是否完全水解,检验是否水解时应检验葡萄糖,故C错误;
D.酸甲脂和丙醛均含-CHO,均可发生银镜反应,则用银氨溶液不能检验甲酸甲脂和丙醛,故D错误;
故选B.
点评 本题考查有机物的鉴别和检验,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度均为0.1 mol•L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同 | |
| B. | 25℃时,在0.1 mol•L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小于7 | |
| C. | 25℃时,将0.1 mol•L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7 | |
| D. | 将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水:Na+、K+、NO${\;}_{3}^{-}$、NH3•H2O | |
| B. | 空气:CO、CO2、SO2、CH4 | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 浓高锰酸钾溶液;H+、Na+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
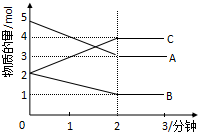 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池放电的时候,负极材料是Ni(OH)2 | |
| B. | 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化 | |
| C. | 充电时,阴极附近PH增大 | |
| D. | 充电时,阳极反应是Cd(OH)2+2e-=Cd+2 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com