
某研究性学习小组探究强碱和不同的酸的中和反应,过程如下:
(1)实验步骤:
①分别配制浓度均为0.1 mol·L-1的NaOH、HCl、CH3COOH溶液备用。配制过程中用到的玻璃仪器有量筒、烧杯、容量瓶、玻璃棒、细口瓶、__________。
②在锥形瓶中加入10 mL 0.1 mol·L-1的HCl溶液,在25.00 mL________(填“酸式”或“碱式”)滴定管中加入0.1 mol·L-1的NaOH溶液,连接数据采集器和pH传感器。
③向锥形瓶中滴入NaOH溶液,接近估算的NaOH溶液用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH溶液。
④利用计算机绘制pH变化图。
用0.1 mol·L-1的CH3COOH溶液代替HCl溶液重复上述②~④的实验操作。
(2)结果分析:
20 ℃时,用NaOH溶液分别滴定HCl、CH3COOH溶液的pH变化曲线如下。
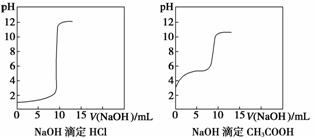
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20 ℃时该浓度醋酸的电离度为______________;
②滴定开始后醋酸pH变化比盐酸快的原因是____________________________;
③盐酸恰好完全反应时pH=7,而醋酸恰好完全反应时pH在8左右的原因是________________________________________。
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是(双选)( )
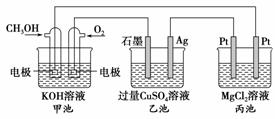
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO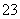 +8H+
+8H+
C.反应一段时间后,向乙池中加入一定量CuO或CuCO3固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O 的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.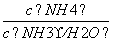 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH )=c(CH3COO-)
)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,H2CO3的K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的K=1.75×10-5。下列有关0.1 mol·L-1的(NH4)2CO3、NH4HCO3溶液的说法中正确的是(双选)( )
A.NH4HCO3溶液呈中性
B.(NH4)2CO3溶液呈碱性
C.(NH4)2CO3溶液中,c(NH )+c(NH3·H2O)=2[cCO
)+c(NH3·H2O)=2[cCO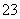 )+c(HCO
)+c(HCO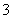 )+c(H2CO3)]
)+c(H2CO3)]
D.等物质的量浓度的两种溶液中的NH 浓度:前者一定是后者的2倍
浓度:前者一定是后者的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
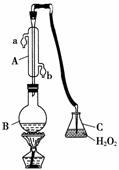
图1
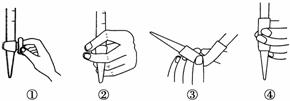
图2
(1)仪器A的名称是______,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)____________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.天然气、石油都是清洁的可再生能源
B.在燃煤中添加碳酸钙或生石灰可以减少SO2的排放
C.在AgCl饱和溶液中加入AgNO3溶液,达平衡时,溶液中Ksp(AgCl)降低
D.地沟油和矿物油都属于酯类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
“地沟油”被称为“生物燃料”,该燃料属于生物质能。已知生物质的主要转化途径及主要产物如下图所示。则下列关于生物燃料以及生物质能的说法中正确的是( )
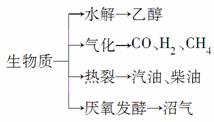
①生物燃料本质上能量来源于太阳能 ②由纤维素水解获得的乙醇属于生物质能 ③生物质裂解获得的汽油、柴油等属于纯净物 ④由植物秸秆等发酵获得的沼气,主要成分是甲烷 ⑤生物质资源是一种污染小的可再生能源
A.①②③④⑤ B.①②④⑤
C.③④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列5种混合溶液,分别由0.1 mol·L-1的两种溶液等体积混合而成:①CH3COONa与NaHSO4,②CH3COONa与NaOH,③CH3COONa与NaCl,④CH3COONa与NaHCO3,⑤CH3COONa与NaHSO3。下列各项排序正确的是( )
A.pH:②>④>⑤>③>①
B.c(CH3COOH):①>③>⑤>④>②
C.c(CH3COO-):②>③>④>⑤>①
D.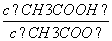 :①>⑤>③>④>②
:①>⑤>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
请订正下面的错误。
(1)硫在足量氧气中燃烧:2S+3O2===2SO3。
________________________________________________________________________。
(2)AlCl3溶液呈酸性的原因:Al3++3H2O===Al(OH)3↓+3H+。
________________________________________________________________________。
(3)NaOH溶液与稀硫酸反应的离子方程式:2H++2OH-===2H2O。
________________________________________________________________________。
(4)工业合成氨反应:N2+3H2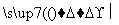 2NH3。
2NH3。
________________________________________________________________________。
(5)工业上用氧化铝为原料制备金属铝:2Al2O3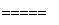 4Al+3O2↑。
4Al+3O2↑。
________________________________________________________________________。
(6)NH4Cl溶液和NaOH溶液加热反应:NH +OH-NH3·H2O。
+OH-NH3·H2O。
________________________________________________________________________。
(7)钢铁吸氧腐蚀,正极的电极反应:O2+2H2O===4OH-+4e-。
________________________________________________________________________。
(8)实验室制取氯气的离子方程式:MnO2+4HCl===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(9)铜与浓硝酸反应:Cu+4HNO3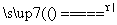 Cu(NO3)2+2NO2↑+2H2O。
Cu(NO3)2+2NO2↑+2H2O。
________________________________________________________________________。
(10)1 g肼气体燃烧生成氮气和水蒸气,放出热量16.7 kJ。反应的热化学方程式:N2H4+O2===N2+2H2O
ΔH=+16.7 kJ。
________________________________________________________________________。
(11)用惰性电极电解硫酸铜溶液的离子方程式:
2Cu2++4OH-===2Cu+O2↑+2H2O。
________________________________________________________________________。
(12)Ba(OH)2溶液与稀硫酸反应的离子方程式:
Ba2++OH-+H++SO ===BaSO4↓+H2O。
===BaSO4↓+H2O。
________________________________________________________________________。
(13)铝—海水电池的负极反应式:Al-3e-+4OH-===AlO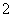 +2H2O。
+2H2O。
________________________________________________________________________。
(14)碳酸氢钠在水中电离:NaHCO3Na++H++CO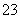 。
。
________________________________________________________________________。
(15)HCO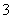 的水解方程式:HCO
的水解方程式:HCO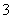 +H2OH3O++CO
+H2OH3O++CO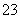 。
。
________________________________________________________________________。
(16)NaHSO4熔化时电离方程式:NaHSO4===Na++H++SO 。
。
________________________________________________________________________。
(17)NH4Cl溶液呈酸性的原因:NH +H2ONH4OH+H+。
+H2ONH4OH+H+。
________________________________________________________________________。
(18)铜与浓硫酸反应:Cu+2H2SO4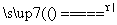 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
________________________________________________________________________。
(19)NH4Cl固体和消石灰加热制NH3:2NH4Cl+Ca(OH)2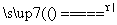 CaCl2+2NH3↑+H2O。
CaCl2+2NH3↑+H2O。
________________________________________________________________________。
(20)实验室制Cl2:4HCl(浓)+MnO2===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(21)实验室利用H2O2分解制O2:2H2O2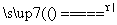 2H2O+O2↑。
2H2O+O2↑。
________________________________________________________________________。
(22)1 g氢气在足量氧气中燃烧生成液态水时,放出热量142.9 kJ,热化学方程式可表示为
 H2(g)+
H2(g)+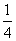 O2(g)
O2(g)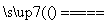
 H2O(l) ΔH=-142.9 kJ。
H2O(l) ΔH=-142.9 kJ。
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com