
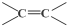 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$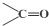 +
+
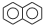 ,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).
,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).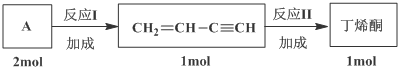
 .
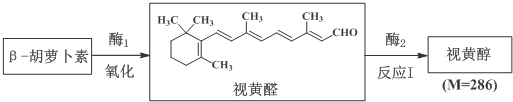
. 分析 (1)在体内酶的催化下,1mol β-胡萝卜素可氧化为2mol视黄醛,根据视黄醛的结构简式及题中信息可知,β-胡萝卜素的结构简式为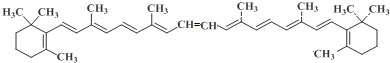 ,根据视黄醛的结构简式可知视黄醛的相对分子质量为284,而视黄醇的相对分子质量为286,所以反应I为视黄醛与氢气加成,将醛基还原为羟基;
,根据视黄醛的结构简式可知视黄醛的相对分子质量为284,而视黄醇的相对分子质量为286,所以反应I为视黄醛与氢气加成,将醛基还原为羟基;
(2)β-胡萝卜素为酯溶性维生素,β-胡萝卜素中含有多个不饱和键,具有还原性,据此答题;
(3)视黄醛的分子式为C20H28O,其不饱和度为7,而 中不饱和度也是7,所以该同分异构体应为在
中不饱和度也是7,所以该同分异构体应为在 环上连有饱和的基团,所以分子中可能羟基,当羟基连在奈环上有酚的性质,连在碳链上有醇的性质,据此答题;
环上连有饱和的基团,所以分子中可能羟基,当羟基连在奈环上有酚的性质,连在碳链上有醇的性质,据此答题;
(4)根据转化关系,2molA生成1molCH2=CHC≡CH,可推知A为CH≡CH,A发生加成反应得CH2=CHC≡CH,CH2=CHC≡CH与水加成得丁稀酮,据此答题.
解答 解:(1)在体内酶的催化下,1mol β-胡萝卜素可氧化为2mol视黄醛,根据视黄醛的结构简式及题中信息可知,β-胡萝卜素的结构简式为 ,所以β-胡萝卜素的化学式为C40H56,根据视黄醛的结构简式可知视黄醛的相对分子质量为284,而视黄醇的相对分子质量为286,所以反应I为视黄醛与氢气加成,将醛基还原为羟基,即反应I为还原反应,
,所以β-胡萝卜素的化学式为C40H56,根据视黄醛的结构简式可知视黄醛的相对分子质量为284,而视黄醇的相对分子质量为286,所以反应I为视黄醛与氢气加成,将醛基还原为羟基,即反应I为还原反应,
故答案为:C40H56;还原反应;
(2)β-胡萝卜素为酯溶性维生素,所以适合作为溶剂的是油脂,选b,β-胡萝卜素中含有多个不饱和键,具有还原性,在保健品中可作抗氧化剂,选c,
故答案为:b;c;
(3)视黄醛的分子式为C20H28O,其不饱和度为7,而 中不饱和度也是7,所以该同分异构体应为在
中不饱和度也是7,所以该同分异构体应为在 环上连有饱和的基团,所以分子中可能羟基,当羟基连在奈环上有酚的性质,连在碳链上有醇的性质,
环上连有饱和的基团,所以分子中可能羟基,当羟基连在奈环上有酚的性质,连在碳链上有醇的性质,
a.该同分异构体中没有碳碳不饱和键,所以不能与溴水发生加成反应,故a错;
b.该同分异构体中可能有酚羟基,所以可能与氯化铁溶液发生显色反应,故b正确;
c.该同分异构体中不可能有醛基,所以不可能发生银镜反应,故c错误;
d.该同分异构体中可能有酚羟基或醇羟基,能使酸性高锰酸钾溶液褪色,故d正确,
故选bd;
(4)根据转化关系,2molA生成1molCH2=CHC≡CH,可推知A为CH≡CH,A发生加成反应得CH2=CHC≡CH,CH2=CHC≡CH与水加成得丁稀酮,反应的方程式为 ,
,
故答案为:CH≡CH; .
.
点评 本题考查有机物的合成,题目难度中等,注意把握有机物的官能团的转化与性质,为解答该类题目的关键,注意有机官能性质的灵活运用.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑤ | C. | ④⑤⑧ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 群众向高处转移 | |
| B. | 用沾NaOH溶液的湿毛巾捂住口鼻 | |
| C. | 用高压水枪向空中喷洒含碱性物质的水溶液可解毒 | |
| D. | 用沾Na2CO3溶液的湿毛巾捂住口鼻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物不可能含有共价键 | B. | 构成晶体的粒子一定含有共价键 | ||
| C. | 共价化合物中不可能含有离子键 | D. | 分子中一定含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN | B. | CH3COOH | C. | HNO2 | D. | HF |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ①② | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com