
| ||
| ||
| 19.2g |
| 64g/mol |
| 6 |
| 6 |
| c×V×10-3×250 |
| a |
| 100mL |
| 25mL |
| cV |
| a |
| cV |
| a |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
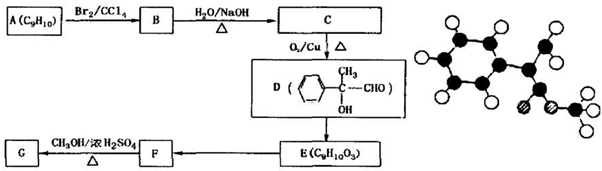
 表示(其中X、Y均不为H),且能发生银镜反应的物质有
表示(其中X、Y均不为H),且能发生银镜反应的物质有查看答案和解析>>
科目:高中化学 来源: 题型:
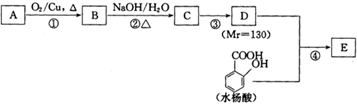
| NaOH/H2O |
| △ |
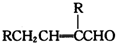
| 反应物1 |
| 反应条件1 |
| 反应物2 |
| 反应条件2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
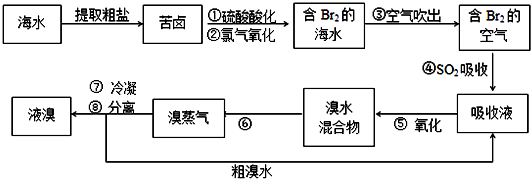
查看答案和解析>>
科目:高中化学 来源: 题型:
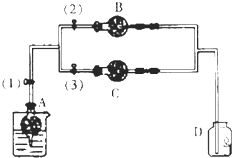 在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止.
在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuO→Cu(OH)2 |
| B、Al2O3→Al(OH)3 |
| C、SiO2→H2SiO3 |
| D、Fe→FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com