
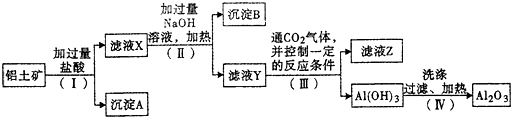
| ||
| ||


科目:高中化学 来源: 题型:
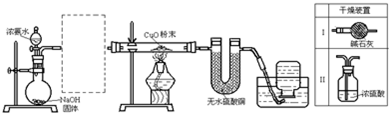
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 试剂及方法 | 供选择的化学试剂及实验方法 |
| 鉴别MgCl2和AlCl3 | A、加入稀盐酸 | |
| 证明NaCl溶液中含有Na2SO4 | B、加入过量烧碱溶液 | |
| 除去Na2CO3中少量NaHCO3 | C、加热至恒重 | |
| 证明CaO粉末中含有铝粉 | D、加入BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
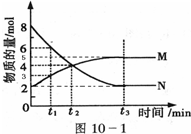 Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1所示装置可制取乙炔 |
| B、图2所示装置可分离乙酸乙酯和醋酸钠的水溶液 |
| C、图3所示装置可制取乙烯并验证其易被氧化 |
| D、图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.5g |
| B、13.2g |
| C、11.2g |
| D、24.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com