
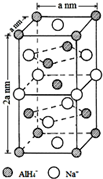
 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. (标明配位键).
(标明配位键).分析 (1)Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,根据原子轨道中电子的填充规则画出其价电子轨道表示式;
(2)离子晶体的熔沸点较高,一般不溶于有机溶剂;NaH是离子化合物,其电子式由阴、阳离子的电子式组合而成;
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,则分子式为Al2Cl6,氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
(4)先求出中心原子的价层电子对数,再判断杂化类型;根据等电子体的结构相似;
(5)以底面Na+离子研究,与之最近的AlH4-位于同一面的4个顶角以及其余4个侧面的面心上;根据晶胞类型以及化学式计算出晶胞所含原子数,根据公式ρ=$\frac{m}{V}$计算得到;根据晶胞中AlH4-的个数为4,钠离子的个数为4来解答;
(6)根据NaAlH4的释氢机理得出产物,从而写出方程式.
解答 解:(1)Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,价电子轨道表示式为 ;
;
故答案为: ;
;
(2)NaH的熔点为800℃,不溶于有机溶剂,属于离子晶体;NaH是离子化合物,电子式为Na+[:H]-;
故答案为:离子;Na+[:H]-;
(3)氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,如图 ;
;
故答案为:分子; ;
;
(4)AlH4-中,Al的价层电子对数=4+$\frac{1}{2}$(3+1-1×4)=4,所以Al原子为sp3杂化;等电子体的结构相似,所以AlH4-空间构型相同的两种离子NH4+、BH4-(或“SO42-”“PO43-”);
故答案为:sp3;NH4+、BH4-(或“SO42-”“PO43-”);
(5)以底面Na+离子研究,与之最近的AlH4-距离为$\frac{\sqrt{2}}{2}$anm,位于同一面的4个顶角以及其余4个侧面的面心上,共有8个;
根据均摊法可知,晶胞中钠离子的个数为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,晶体的化学式为NaAlH4,所以晶胞中AlH4-的个数为4,该晶胞的质量为$\frac{54×4}{{N}_{A}}$g,该晶胞体积为2a3nm3=2a3×10-21cm3,则该晶胞的密度为$\frac{\frac{216}{{N}_{A}}}{2{a}^{3}×10{\;}^{-21}}$g•cm-3=$\frac{108×1{0}^{21}}{2{a}^{3}{N}_{A}}$g•cm-3;
晶胞中AlH4-的个数为4,钠离子的个数为4,若NaAlH4晶胞底心处的Na+被Li+取代,则晶胞中AlH4-的个数为4,钠离子的个数为3,锂离子的个数为1,晶体的化学式为:Na3Li(AlH4)4;
故答案为:8;$\frac{108×1{0}^{21}}{2{a}^{3}{N}_{A}}$g•cm-3;Na3Li(AlH4)4;
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,即产物有Al、H2和AlH63-,方程式为:3NaAlH4═Na3AlH6+2Al+3H2↑;
故答案为:3NaAlH4═Na3AlH6+2Al+3H2↑.
点评 本题主要考查了核外电子排布、电子式、化学键、分子空间构型、杂化方式、晶胞密度的计算,方程式的书写,难度较大,解题时要注意对基本知识的灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大量共存 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol/LCH3COONa溶液的pH | pH试纸都变成碱色 | 可以用pH试纸的颜色与标准比色卡比较,从而判断HClO和CH3COOH的酸性强弱 |
| D | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量Na2S溶液 | 开始有白色沉淀生成,后有黑色沉淀生成 | Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,64 g SO2含有的原子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol镁与足量稀硫酸反应时失去的电子数目为2 NA | |
| D. | 1 mol•L-1K2SO4溶液中含有的钾离子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L 盐酸 | pH=3 盐酸 | 0.1mol/L 氨水 | pH=11 氨水 |
| A. | 由水电离出的c(H+):①>③ | |
| B. | ③稀释到原来的100倍后,pH与④相同 | |
| C. | ①与③混合,若溶液pH=7,则V(盐酸)>V(氨水) | |
| D. | ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜的熔点比纯铜和锡都高 | B. | 陶瓷的主要成分为硅酸盐 | ||
| C. | 古代的纸张主要成分为蛋白质 | D. | 黑火药爆炸时,氧化剂只有硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | K2CO3 | C. | HNO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中提取溴、碘都涉及置换反应,从矿物质中获取铝、铁、铜、硅都不涉及置换反应 | |
| B. | 利用溶解度数据可推测将一些混合物质分离开来的可能性,利用原子半径数据可推测某些原子的氧化性和还原性的强弱 | |
| C. | 因为食盐能使细菌变性,所以可以用食盐水杀死H7N9禽流感病毒 | |
| D. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com