
实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)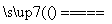 ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式)。产生这种结果的主要原因是________(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
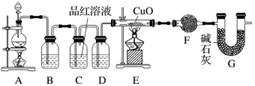
①装置B中加入的试剂为________,作用是________。
②装置D加入的试剂为________________,装置F加入的试剂为________________。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是________。
④U形管G的作用为________。
答案 (1)H2 随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2:Zn+H2SO4===ZnSO4+H2↑
(2)①NaOH溶液(或酸性KMnO4溶液,其他合理答案也可)
除去混合气体中的SO2 ②浓硫酸 无水硫酸铜
③装置E玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色
④防止空气中的H2O进入干燥管F而影响杂质气体的检验
解析 (1)从物质的量关系来看,发生反应Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,H2SO4略过量,但是实际上随着反应的进行,硫酸的浓度降低;当硫酸的浓度降到一定程度,反应变为Zn+H2SO4===ZnSO4+H2↑。(2)该实验的目的是为了通过加热还原CuO验证H2的存在,通过 F装置进一步确认有H2O生成;具体的实验装置及作用是A—产生待研究的气体,B—除去气体中的SO2(可以利用SO2的性质选取NaOH溶液或酸性高锰酸钾溶液),C—验证SO2已除尽,D—干燥气体,E—若有H2,则加热E玻璃管,CuO固体由黑色变为红色,F—利用无水硫酸铜吸水变蓝进一步确定气体中H2的存在,G—防止空气中的水蒸气进入F装置而干扰实验。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.离子晶体中,只存在离子键,不可能存在其他化学键
B.在氧族元素(O、S、Se、Te)的氢化物中,水的沸点最低
C.NaHSO4、Na2O2晶体中的阴阳离子个数比均为1∶2
D.晶体的熔点:金刚石>碳化硅>单晶硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.煤的液化和气化都是物理变化
B.乙醇、乙酸和甲醛广泛应用于食品加工
C.蛋白质、橡胶和塑料都是天然高分子
D.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3===K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为1.25 mol
D.氧化产物的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe3+、SO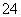 、Al3+和X四种离子以物质的量之比2∶4∶1∶1大量共存于同一溶液中,则X可能是( )
、Al3+和X四种离子以物质的量之比2∶4∶1∶1大量共存于同一溶液中,则X可能是( )
A.Na+ B.Cl- C.CO D.OH-
D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_______________________________________
________________________________________________________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________________
________________________________________________________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有______________________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=__________________,V6=__________,V9=________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)在原电池中,发生氧化反应的一极一定是负极( )
(2)在原电池中,负极材料的活泼性一定比正极材料强( )
(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )
(4)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲烷燃料电池为例来分析不同的环境下电极反应式的书写。
(1)酸性介质(如H2SO4)
负极:________________________________________________________________________;
正极:________________________________________________________________________;
总反应式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法的名称是______________。
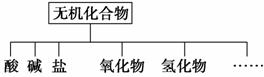
(2)
| 物质 类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②_____ | ③_____ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com