
| A���зḻ��������Դ�ij��� | B��������������γ��� |
| C��������������Ĺ�ҵ���� | D���˿ڳ��ܵ��Ļ�����ҵ���ij��� |
 SO3 ��H <0���ֽ�0��050mol SO2��0��030mol O2
SO3 ��H <0���ֽ�0��050mol SO2��0��030mol O2| ����¯�¶�/�� | 600 | 620 | 640 | 660 |
| ¯����CuSO4����������/% | 9��3 | 9��2 | 9��0 | 8��4 |
 4CuO+2Fe2O3+8SO2
4CuO+2Fe2O3+8SO2 4CuO+2Fe2O3+8SO2
4CuO+2Fe2O3+8SO2

 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���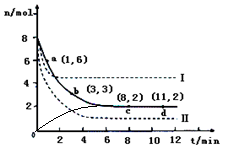
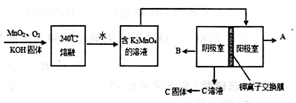
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ٺ�ɫ��ȥ��ԭ�������KMnO4��SCN-������ʹ[Fe��SCN��]2+��ʧ |
| B��[Fe��SCN��]2+��Fe3+��SCN-����λ����ϡ� |
| C���ں�ɫ��ȥ��ԭ����SO2����Ư���� |
| D��SCN-���ʵ������¿�ʧȥ���ӱ�����������Ϊ��SCN��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI(g)���ܱ������з�Ӧ���ﵽƽ��״̬ʱ�ı�־�ǣ� ��
2HI(g)���ܱ������з�Ӧ���ﵽƽ��״̬ʱ�ı�־�ǣ� �� | A�����������ܶȲ��ٸı� | B������������ɫ���ٸı� |
| C����������ѹǿ���ٸı� | D��I2��H2�ڻ�������е����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 H2(g)+CO2(g)����Ӧ��???�вⶨ�IJ������ݼ��±���
H2(g)+CO2(g)����Ӧ��???�вⶨ�IJ������ݼ��±���| ��Ӧʱ��/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |

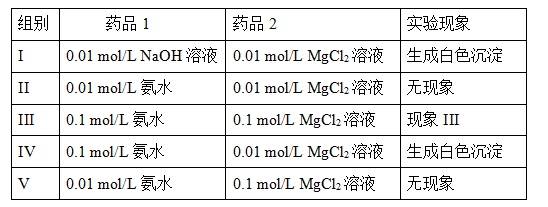
 2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ��
2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cP(g)��dQ(g)�ﵽƽ��ʱ��M���������y(M)�뷴Ӧ�����Ĺ�ϵ��ͼ��ʾ������z��ʾ��Ӧ��ʼʱN�����ʵ�����M�����ʵ���֮�ȣ�����˵����ȷ����(����)
cP(g)��dQ(g)�ﵽƽ��ʱ��M���������y(M)�뷴Ӧ�����Ĺ�ϵ��ͼ��ʾ������z��ʾ��Ӧ��ʼʱN�����ʵ�����M�����ʵ���֮�ȣ�����˵����ȷ����(����)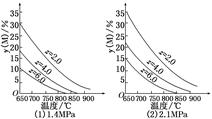
| A��ͬ��ͬѹͬzʱ�����������ƽ��ʱQ������������� |
| B��ͬѹͬzʱ�������¶ȣ�ƽ��ʱQ������������� |
| C��ͬ��ͬzʱ������ѹǿ��ƽ��ʱQ������������� |
| D��ͬ��ͬѹʱ������z��ƽ��ʱQ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
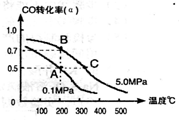
 N2O4������ӦΪ���ȷ�Ӧ����������ƿ����100��ķ�ˮ�У��������������ɫ����ƽ����Է�������������������ѹǿ�����ܶȡ����в������
N2O4������ӦΪ���ȷ�Ӧ����������ƿ����100��ķ�ˮ�У��������������ɫ����ƽ����Է�������������������ѹǿ�����ܶȡ����в������| A���ڢ� | B���ۢ� | C���ۢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
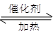 CO2(g)��H2(g)��H��0����Ӧ�ﵽƽ��״̬�������CO��ת���ʣ����Բ�ȡ�Ĵ�ʩΪ
CO2(g)��H2(g)��H��0����Ӧ�ﵽƽ��״̬�������CO��ת���ʣ����Բ�ȡ�Ĵ�ʩΪ| A������ѹǿ | B�������¶� | C������CO��Ũ�� | D�������CO2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com