
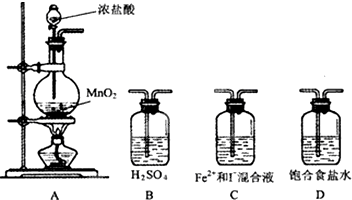
 某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 向B试管中滴加 | ①若 ②若 ③若 |
| 实验步骤 | 预期现象和结论 |
| KSCN; 淀粉 | ①A变红色,B不变色 ②A不变色,B变蓝色 ③A变红色,B变蓝色 |
| 1.52g |
| 152g/mol |
| 1.66g |
| 166g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3
把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3| X |
| Y |
| 1 |
| 4 |
| X |
| Y |
| 2 |
| 3 |
| X |
| Y |
| 1 |
| 4 |
| X |
| Y |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成纤维和光导纤维都是新型无机非金属材料 |
| B、乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 |
| C、淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体 |
| D、乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请回答下列问题.
请回答下列问题.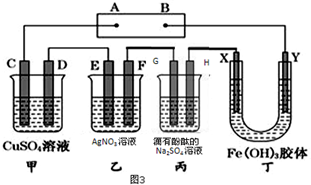
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4L CO2中含有NA个CO2分子 |
| B、17.6g丙烷中所含的极性共价键为4NA个 |
| C、1.7g H2O2中含有的电子数为0.9NA |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| B、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| C、绿色化学的核心是从源头上消除工业生产对环境的污染 |
| D、用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
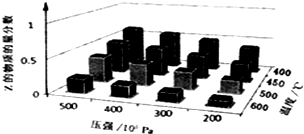 为了探究外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( )
为了探究外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( )| A、△H>0,a+b>c |
| B、△H>0,a+b<c |
| C、△H<0,a+b>c |
| D、△H<0,a+b<c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com