
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化的PbO2、还有组成类似Fe3O4的Pb3O4 ,请将Pb3O4 改写成简单氧化物的形式: _________。
II.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO 、PbO2、PbSO4等)为原料,制备超细PbO ,实现铅的再生利用。其工作流程如下:
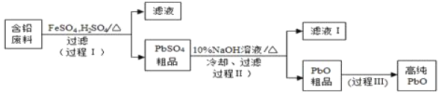

(2)步骤① 的目的是“脱硫”,即将PbSO4转化PbSO3,反应的离子方程式为_______________________。
“脱硫过程”可在如图所示的装置中进行,实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h.。
①仪器a的名称是 __________;转化温度为35 ℃, 采用的合适加热方式是________。
②步骤②中H2O2的作用是 __________________ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A _____________(填装置字母代号),证明产物中有CO气体的实验现象是________________。

(4)测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+ (反应方程式为Pb2++H2Y2-= PbY2- +2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL
①若滴定管未用 EDT A 标准液润洗,测定结果将_________ (填“偏高” “偏低” 或“不变”)。
②草酸铅的纯度为 __________(保留四位有效数字)。
【答案】2PbOPbO2 CO32— +PbSO4 = SO42—+PbCO3 三颈(口)烧瓶 热水浴 PbO2+H2O2+2HNO3 =Pb(NO3)2+2H2O+O2↑ BCBDEBF E中黑色粉未变为红色、其后的B中澄清石灰水变混浊 偏高 85.67%
【解析】
I.(1)Pb在化合物中的化合价有+2价、+4价,改写氧化物时要遵循化合价不变、原子守恒,据此书写;
Ⅱ.铅膏废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,铅膏中加入碳酸铵目的是“脱硫”,即将PbSO4转化为PbCO3,过氧化氢和稀硝酸还原PbO2生成硝酸铅溶解,脱硫、浸取、氧化反应过滤得到滤液中加入草酸钠溶液过滤,得到草酸铅沉淀,550°C煅烧得到超细PbO,草酸铅受热分解生成PbO时,还有CO和CO2生成,检验这两种气体,需要先检验二氧化碳,然后除去二氧化碳,在将CO转化为二氧化碳检验CO,据此分析解答。
I.(1)Pb在化合物中的化合价有+2价、+4价,则Pb3O4写成两种氧化物的形式为2PbOPbO2,故答案为:2PbOPbO2;
Ⅱ.(2)步骤①的目的是“脱硫”,将PbSO4转化为溶解度更小的PbCO3,沉淀转化的离子方程式为:CO32-+PbSO4=SO42-+PbCO3,故答案为:CO32-+PbSO4=SO42-+PbCO3;
①根据图示,仪器a为三颈烧瓶,转化温度为35℃,采用的合适加热方式为水浴加热,故答案为:三颈烧瓶;水浴加热;
②步骤②中H2O2的作用是在酸性条件下还原PbO2生成硝酸铅,反应的化学方程式为:PbO2+H2O2+2HNO3=Pb(NO3)2+2H2O+O2↑,故答案为:PbO2+H2O2+2HNO3=Pb(NO3)2+2H2O+O2↑;
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,利用A加热分解草酸铅,装置B检验二氧化碳的生成,通过装置C除去二氧化碳,装置B检验二氧化碳是否除净,通过D装置吸收水蒸气,通过E装置加热一氧化碳和氧化铜反应生成铜和二氧化碳,通过B装置检验生成的二氧化碳存在,最后排水法收集气体,依次连接的合理顺序为ABCBDEBF,证明生成一氧化碳的实验现象E中黑色粉末变为红色,其后的B中澄清石灰水变浑浊,故答案为:BCBDEBF;E中黑色粉末变为红色,其后的B中澄清石灰水变浑浊;
(4)①滴定管未用EDTA标准溶液润洗,内层水膜会稀释标准溶液,导致消耗的标准溶液的体积偏大,测定结果偏高,故答案为:偏高;
②取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+反应方程式为 H2Y2-+Pb2+=PbY2-+2H+,(杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL,则消耗EDTA的物质的量=0.01452L×0.0500mol/L=7.26×10-4mol,根据Pb2++H2Y2-=PbY2-+2H+,结合Pb守恒有n(PbC2O4)=n( Pb2+)=7.26×10-4mol,250mL溶液中n(PbC2O4)=7.26×10-4mol×![]() ,草酸铅的纯度=
,草酸铅的纯度= ×100%=85.67%,故答案为:85.67%。
×100%=85.67%,故答案为:85.67%。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列氯代烃中不能由烯烃与氯化氢加成直接得到的有( )
A. 2一乙基—4—氯—1—丁烯 B. 氯代环己烷
C. 2,2,3,3—四甲基—1—氯丁烷 D. 3一甲基—3—氯戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
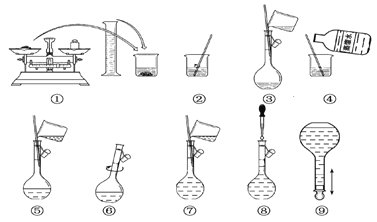
【题目】以下为配制250 mL 0.2 mol·L-1 Na2CO3溶液的示意图。
回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转并摇动多次
(2)①中称得Na2CO3________g。
(3)玻璃棒在②、③两步中的作用分别是________、________。
(4)若出现如下情况,所配溶液浓度偏低的有:________
A.某同学在第⑧步观察液面时仰视;
B.没有进行操作步骤④和⑤;
C.在第⑤步不慎有少量液体流到容量瓶外;
D.在步骤①中,药品放在右盘,砝码放在左盘(使用游码)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计步骤用滴定法测定AgBrO3的溶度积常数.回答下列问题:
步骤I:试剂的配制
分别配制1L0.025molL-1KBrO3溶液、1L0.025rrolL-1AgNO3溶液、lL0.05molL-1Na2S2O3溶液。
(1)配制Na2S2O3溶液所使用的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除______________(写名称)及二氧化碳。
步骤II:AgBrO3饱和溶液配制
用棕色滴定管量取20.00mL0.025molL-1AgNO3溶液于干燥的锥形瓶中,然后用另一支滴定管量取20.00mL0.025molL-1KBrO3溶液注入到锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化3~5min,用过滤器过滤,滤液用于燥洁净的小烧杯盛接。
(2)量取AgNO3溶液所使用的滴定管为棕色的目的是______________。
(3)如果滤液浑浊需要进行的操作为______________。
步骤III:AgBrO3饱和溶液中BrO3-浓度的测定
准确量取20.00mL所得滤液注入碘量瓶中,再加入20mL10%的KI溶液、l5mLlmolL-1的硫酸并加50.00rnL水混匀,放置3~5min,以淀粉为指示剂,用Na2S2O3溶液滴定,消耗Na2S2O3溶液17.86mL(发生的反应BrO3-+6H++6I-=Br-+3I2+3H2O;2Na2S2O3+I2=Na2S4O6+2NaI)。
(4)滴定到终点时的现象为______________。
(5)滤液中BrO3-的浓度为______________(保留3位有效数字,下同),AgBrO3的溶度积测定值为______________。
(6)步骤II中滤液若没有澄清,会使测量值______________(填“偏高”“偏低”或“无影响”,下同);盛接滤液的小烧杯中有少量水存在,会使测量值________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、NO2、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(1)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以NO2将还原为N2。已知:
CH4 (g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJmol-1 ①
N2 (g) +2O2(g)=2 NO2 (g) △H2=+67.7kJmol-1 ②
则反应CH4 (g)+2NO2(g)=CO2(g)+ N2 (g)+ 2H2O(l) △H= _____________ 。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4 (g)+ NH3 (g) ![]() HCN(g)+ 3H2 (g) △H>0
HCN(g)+ 3H2 (g) △H>0
①在一定温度条件下,向2L恒容密闭容器中加入2mol CH4和2mol NH3,平衡时NH3 体积分数为30%,所用时间为10min,则该时间段内用CH4的浓度变化表示的反应速率为__________________molL-1min-1 ,该温度下平衡常数K=_________。若保持温度不变,再向容器中加入CH4 和H2各1mol,则此时v正= ________ (填“>”“=”或“<”)v逆。
②其他条件一定,达到平衡时NH3 转化率随外界条件X 变化的关系如图1所示,X 代表 __________(填字母代号)
A.温度 B. 压强 C. 原料中CH4与NH3的体积比
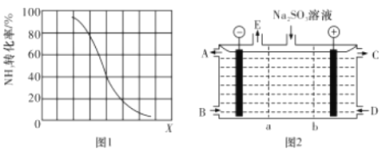
(3)某研究小组用NaOH 溶液吸收尾气中的二氧化碳,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨,A~E分别代表生产中的原料或产品,b表示_____(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
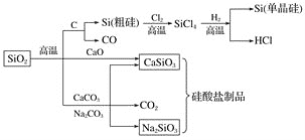
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用如下图装置(2个三颈烧瓶及其他仪器)制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
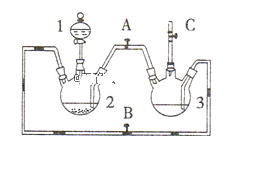
(1)稀硫酸应放在_____________中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,可将仪器中的空气排尽,具体操作为:关闭开关_______,打开开关________,打开分液漏斗活塞;待反应一段时间排尽空气后,再关闭开关_______,打开开关_______,就可观察到氢氧化亚铁的颜色。试分析实验开始时需排尽装置中空气的理由_______________________________(用化学反应方程式作答)。
探究思考 :
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色。在查阅不同资料后,有同学认为灰绿色物质是Fe(OH)2被空气中的氧气氧化后生成的Fe3(OH)8。
(3)Fe3(OH)8中n(Fe2+):n(Fe3+) =_______,用氧化物的形式表示可写成_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+ H+,下列说法正确的是
CH3COO-+ H+,下列说法正确的是
A.向体系中加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
B.向体系中加水稀释,平衡向右移动,溶液中所有离子的浓度都减小
C.加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大
D.升高体系温度(忽略醋酸挥发),溶液中H+数目增多,平衡一定向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
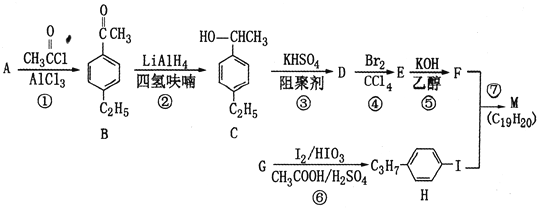
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单二苯乙炔类化合物是![]() 。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
回答下列问题:
(1)G的结构简式为________________。
(2)C中含有的官能团名称是________________________。
(3)反应②的反应类型是________________,反应⑥的反应类型是________________。
(4)反应⑤的化学方程式为____________________。
(5)能同时满足下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有两个取代基 ②能发生银镜反应
写出其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式_______。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线。_________________________
的合成路线。_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com