
A、B、C、D为中学化学四种常见物质,A为红棕色气体,它们之间的相互转化关系如右图。已知:A+H2O→M+C;D+H2O→N,M、N是酸雨的主要成分。
(1)写出下列反应化学方程式
①A+H2O→M+C 。
②A+B→C+D 。
(2)下列哪些物质不能与N的浓溶液反应 。
a.NH3 b.H2 c.SO2 d.H2S
(3)下列实验方案可以用于在实验室制取B的是 。
a.Na2SO3溶液与HNO3 b.Na2SO3固体与浓硫酸
c.固体硫在纯氧中燃烧 d.铜与浓H2SO4加热
(4)某同学认为:将A通入到Na2S溶液中能够证明A的氧化性,此说法是否正确 (填“是”或“否”),请说明理由 。
(1)①3NO2 +H2O=2HNO3+NO②NO2+ SO2=NO+ SO3(2)b c(3)b d (4)否(;NO2和水反应生成的HNO3是一种氧化性酸,也能将Na2S氧化,使溶液变浑浊.
解析试题分析:(1)根据图可知:A是红棕色的气体,它与水反应生成酸雨的主要成分,则A:NO2, M :HNO3:C是NO. N也是酸雨的主要成分,则N是H2SO4。则D是SO3.B是SO2.反应的相应方程式为:①3NO2 +H2O=2HNO3+NO ②NO2+ SO2=NO+ SO3。浓H2SO4有强氧化性与硫化氢反应,有酸性与氨气反应,不能反应的选项是bc. (3)在实验室SO2是用Na2SO3固体与浓硫酸反应制取的,铜与浓H2SO4加热也可用于制取。HNO3有强氧化性,它与Na2SO3溶液反应时产生的二氧化硫会被氧化成硫酸,固体硫在纯氧中燃烧造价太大,也不环保、安全。选项为:b d。(4)将NO2通入到Na2S溶液中不能够证明它的氧化性,因为二氧化氮与水反应产生的硝酸也有强的氧化性,可以把硫化氢氧化。故此说法不正确。
考点:考查硫元素、氮元素相应的化合物的性质及酸雨等的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
一定条件下,有如下反应:
2CO (g) + O2(g)=2CO2(g) ΔH1=" -" 566.0kJ·mol-1
3Fe(s) +2O2(g)=Fe3O4 (s) ΔH2=-1118.3kJ·mol-1
Fe3O4(s)+4CO(g) 3Fe(s) +4CO2 (g) ΔH3
3Fe(s) +4CO2 (g) ΔH3
(1)试计算,ΔH3 =
(2)已知1100℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应 (填“是”或“否”)处于平衡状态,理由是 ,此时υ正 υ逆(填“>”、“<”或“=”)。
3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应 (填“是”或“否”)处于平衡状态,理由是 ,此时υ正 υ逆(填“>”、“<”或“=”)。
(3)下列试剂可以用于吸收工业尾气中的CO2的是 。
a.(NH4)2CO3溶液 b.氨水 c.NaHSO3溶液 d.CaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2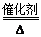 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
| | 注意事项 | 理由 |
| ① | ______________ | ____________ |
| ② | ________________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气的用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅等。
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是 。
(2)工业上生产半导体材料硅的流程如下:
①写出制备粗硅时反应的化学方程式: 。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点、难挥发性液态杂质,必须进行分离提纯,其提纯方法为 (填字母)。
| A.蒸馏 | B.过滤 | C.萃取 | D.结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。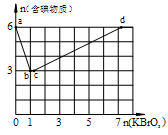
请回答下列问题:
(1)b点时,对应含碘物质的化学式为 。
(2)b→c过程中,仅有一种元素发生化合价变化, 写出该反应的化学方程式 。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为 。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为 。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂之一。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 (反应①)。
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应化学方程式为 (反应②)。
(3)次氯酸不稳定,容易分解,化学反应方程式为 (反应③)。
(4)反应①、反应②、反应③中,属于氧化还原反应的是(填反应编号) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
| A.温室效应 | B.酸雨 | C.粉尘污染 | D.水体富营养化 |
 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
多晶硅生产工艺流程如下: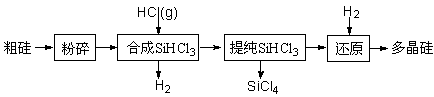
(1)粗硅粉碎的目的是 。分离SiHCl3 (l)和SiCl4(l)的方法为 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3 (g)+ H2 (g)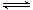 Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
(3)该流程中可以循环使用的物质是 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + =___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: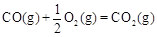 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1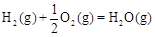 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃
270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。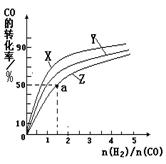
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com