
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
【答案】C
【解析】A.加热时,①上部汇集了固体NH4Cl,是由于加热时氯化铵分解生成氨气和氯化氢,氨气和氯化氢在试管的顶部反应生成氯化铵,不是NH4Cl的热稳定性比较好,故A错误;
B.②中氨水显碱性,使酚酞变红,加热时,氨气逸出,冷却后,氨气又和水反应,变成红色,二氧化硫与品红显无色,加热后二氧化硫逸出,显红色,故B错误;
C.2NO2 (g)N2O4(g)△H=﹣92.4kJ/mol,正反应为放热反应,升高温度平衡向逆反应方向移动,则颜色变深,④中浸泡在热水中的容器内气体颜色变深,反之变浅,所以浸泡在冰水中的容器内气体颜色变浅,故C正确;
D.氯化铵受热分解,与氨气和氯化氢反应生成氯化铵不是可逆反应,因前者须加热,后者只要在常温下,故D错误;
故选:C.
A.氯化铵分解生成氨气和氯化氢,氯化氢和氨气反应生成氯化铵;
B.根据氨气使酚酞变红的原理解答,根据二氧化硫与品红作用的原理解答;
C.根据二氧化氮的可逆反应和化学平衡的原理解答;
D.可逆反应,须在同等条件下,既能向正反应进行,又能向逆反应进行.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】某燃煤发电厂的废气中有SO2,它是形成酸雨的罪魁之一。处理SO2一般用生石灰或类似物质来吸收。下图是处理该废气的装置示意图。

下列说法不正确的是( )
A. 此过程中既有分解反应,也有化合反应
B. CaSO4既是氧化产物,又是还原产物
C. 使用此废气处理装置可减少酸雨的形成
D. 理论上整个过程每转移电子1 mol,会对应生成1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列八种物质:①丙烯、②聚乙烯、③1﹣溴丁烷、④苯、⑤甲苯、⑥1﹣丁醇、⑦苯酚、⑧乙醚
(1)既能与酸性高锰酸钾溶液反应,又能与溴水反应的是(填序号,下同)
(2)互为同系物的有
(3)互为同分异构体的有
(4)写出③与NaOH醇溶液反应的化学方程式
(5)写出⑥在铜催化下被氧化的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+比B3+多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2∶1。试回答:
(1)B是________(写元素符号,下同),E是________。
(2)B的离子结构示意图:________,D的单质分子的电子式:________,C元素最高价氧化物对应的水化物的电子式:________。
(3)用电子式表示H2A形成过程:_____________________。
(4)写出CD的溶液中通入氯气的离子方程式:__________________________。
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱(B、C、E离子用实际离子符号表示):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O式量为278),并进一步计算产品的纯度。
工艺流程如下所示:
(1)烧渣在进行酸溶时用到的酸为。
(2)过程中灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
A.品红溶液
B.紫色石蕊溶液
C.酸性KMnO4溶液
D.红色的酚酞试液
(3)X是 , 此时滤液N中发生反应的离子方程式为。检验溶液Q中含有的金属阳离子的实验方法是。
(4)操作III的操作步骤为蒸发浓缩、、过滤(填操作名称)、、干燥。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①标准液应盛装在滴定管中(填“酸式”或“碱式”),计算上述产品中FeSO4·7H2O的质量分数为;
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O的质量分数。(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是( )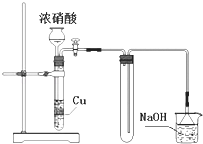
A.用广泛pH试纸测得0.051 molL﹣1 H2SO4溶液的pH=1
B.某气体制备装置如右图,该装置可减少污染性气体的泄漏,且有利于收集到空气含量较低的气体
C.在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出
D.10mL溴水与5mL正己烷混合,在光照下振荡后静置,当试液分为上、下两层且几乎无色时,用玻璃棒蘸取浓氨水伸入液面上方,可观察到有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( ) 
A.该反应的平衡常数表达式为:K= ![]()
B.0~4 min时,A的平均反应速率为0.01 mol/(L?min)
C.由T1向T2变化时,v正>v逆
D.平衡后升高温度,K值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.任何物质的摩尔质量就等于它的相对原子质量或相对分子质量
B.摩尔是国际单位制中七个基本物理量之一
C.CO2的摩尔质量是44g
D.1.5molCH3COOH含有的H数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环上原有取代基对新导入取代基所占的位置有一定影响,其规律是:(1)苯环上新导入的取代基所占的位置主要取决于原有取代基的性质。(2)把原有取代基分成两类:一类取代基主要使新导入的取代基进入苯环的邻位和对位,如-CH3(或烃基)、—Br等;另类取代基主要使新导入的取代基进入苯环的间位,如—NO2、—CHO等。
已知:苯在FeBr3粉存在的条件下与液溴发生取代反应:
![]()

请回答下列问题:
(1)写出A、B、C的结构简式:A_______,B_______,C_______。
(2)写出下列转化的化学方程式,并指明反应类型。
① ________________,______;②________________,______;③________________,______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com