
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
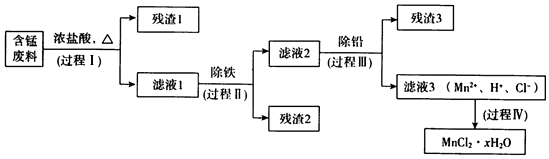
分析 含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)与浓盐酸反应,过滤滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+,过程II除去铁离子,过程III用锰除去铅离子,
(1)①浓盐酸与二氧化锰反应产生氯气;
②检验铁离子用KSCN溶液;
③二氧化锰氧化亚铁离子;
(2)①根据几种离子沉淀的pH数据分析;
②焙烧发除铁:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于6.5;
③氨水法除铁滤液2混有铵根离子;
(3)过程Ⅲ的目的是除铅,用活泼金属置换不活泼金属;
(4)m1gMnCl2•xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则结晶水的质量为(m1-m2)g,根据1:x=n(MnCl2):n(H2O)计算.
解答 解:(1)①浓盐酸与二氧化锰反应产生氯气,反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②铁离子使KSCN溶液显红色,检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红;
故答案为:再滴加KSCN溶液,溶液变红;
③Fe3+由Fe2+转化而成,可能由氯气、氧气氧化,也可能由二氧化锰氧化,反应为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
故答案为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
(2)①调节pH除去铁离子,pH大于3.2时,铁离子沉淀完全,铅离子、锰离子不能沉淀,故pH应小于6.5;
故答案为:3.2~6.5;
②焙烧法除铁,将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于6.5;
故答案为:加水溶解,过滤,再加盐酸酸化至pH小于6.5;
③氨水发除铁,除铁过程中,引入杂质NH4+;
故答案为:引入杂质NH4+;
(3)过程Ⅲ的目的是除铅,用活泼金属置换不活泼金属,加入锰,将铅离子置换与溶液分离,自身生成锰离子,不引入杂质;
故答案为:锰;
(4)m1gMnCl2•xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则n(MnCl2)=$\frac{{m}_{2}}{131}$nol,结晶水的质量为(m1-m2)g,n(H2O)=$\frac{{m}_{1}-{m}_{2}}{18}$,则1:x=n(MnCl2):n(H2O),解得x=$\frac{{7({m_1}-{m_2})}}{m_2}$;
故答案为:$\frac{{7({m_1}-{m_2})}}{m_2}$.
点评 本题考查了物质制备方案设计,为高频考点,侧重于学生的分析、实验能力的考查,题目涉及离子方程式的书写、物质组成的计算等知识,题目难度中等,注意把握实验的流程、相关物质的性质以及题目信息.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | SO2通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | SO2具有还原性 |
| B | 向NaSiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体;溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 浓硫酸滴到湿润的蔗糖中 | 蔗糖变成黑色海绵状 | 浓硫酸具有脱水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | 472 | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
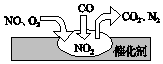 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com